§ 5.6. теплоемкости газа при постоянном объеме и постоянном давлении
Содержание:
- Нагревание и охлаждение
- Таблица удельной теплоемкости некоторых металлов и сплавов
- Краткая теория и методика выполнения работы
- Теплоемкости при постоянном давлении и постоянном объеме
- Удельная теплоемкость газов
- Таблица удельной теплоемкости пищевых продуктов
- Виды теплопередачи
- Таблица удельной теплоемкости пищевых продуктов
- Удельная теплоёмкость
- Рекомендации
- Таблица удельной теплоемкости пищевых продуктов
Нагревание и охлаждение
Эти два процесса знакомы каждому. Вот нам захотелось чайку, и мы ставим чайник, чтобы нагреть воду. Или ставим газировку в холодильник, чтобы охладить.
Логично предположить, что нагревание — это увеличение температуры, а охлаждение — ее уменьшение. Все, процесс понятен, едем дальше.
Но не тут-то было: температура меняется не «с потолка». Все завязано на таком понятии, как количество теплоты. При нагревании тело получает количество теплоты, а при нагревании — отдает.
Виу-виу-виу! Внимание!
Обнаружено новое непонятное слово — теплопередача. Минуточку, давайте закончим с количеством теплоты
В процессах нагревания и охлаждения формулы для количества теплоты выглядят так:
|
Нагревание Q = cm(tконечная — tначальная) Охлаждение Q = cm(tначальная — tконечная) Q — количество теплоты c — удельная теплоемкость вещества [Дж/кг*˚C] m — масса tконечная — конечная температура tначальная — начальная температура |
В этих формулах фигурирует и изменение температуры, о котором мы сказали выше, и удельная теплоемкость, речь о которой пойдет дальше.
А вот теперь поговорим о видах теплопередачи.
Таблица удельной теплоемкости некоторых металлов и сплавов
В таблице даны значения удельной теплоемкости некоторых распространенных металлов и сплавов при температуре 20°С. Значения теплоемкости большинства металлов при других температурах вы можете найти в этой таблице.
| Металлы и сплавы | C, Дж/(кг·К) |
|---|---|
| Алюминий Al | 897 |
| Бронза алюминиевая | 420 |
| Бронза оловянистая | 380 |
| Вольфрам W | 134 |
| Дюралюминий | 880 |
| Железо Fe | 452 |
| Золото Au | 129 |
| Константан | 410 |
| Латунь | 378 |
| Манганин | 420 |
| Медь Cu | 383 |
| Никель Ni | 443 |
| Нихром | 460 |
| Олово Sn | 228 |
| Платина Pt | 133 |
| Ртуть Hg | 139 |
| Свинец Pb | 128 |
| Серебро Ag | 235 |
| Сталь стержневая арматурная | 482 |
| Сталь углеродистая | 468 |
| Сталь хромистая | 460 |
| Титан Ti | 520 |
| Уран U | 116 |
| Цинк Zn | 385 |
| Чугун белый | 540 |
| Чугун серый | 470 |
Краткая теория и методика выполнения работы
Удельной
теплоемкостью
вещества называется величина, равная
количеству теплоты, которую необходимо
сообщить единице массы вещества для
увеличения ее температуры на один градус
Кельвина:
. (4.1)
Теплоемкость
одного моля вещества называется молярной
теплоемкостью:
, (4.2)
где
m – масса, µ – молярная масса вещества,– число молей газа.
Значение
теплоемкости газов зависит от условий
их нагревания. В соответствии с первым
законом термодинамики количество
теплоты,
сообщенное системе, расходуется на
увеличение ее внутренней энергиии на совершение системой работыпротив внешних сил:
. (4.3)
Изменение
внутренней энергии идеального газа в
случае изменения его температурыравно:
, (4.4)
здесь
– число степеней свободы молекулы газа,
под которым подразумевается число
независимых координат, полностью
определяющих положение молекулы в
пространстве;– универсальная газовая постоянная.
При
расширении газа система совершает
работу:
. (4.5)
Если
газ нагревать при постоянном объеме
(),
тои, согласно (4.3), все полученное газом
количество теплоты расходуется только
на увеличение его внутренней энергии.
Следовательно, учитывая (4.4), молярная
теплоемкость идеального газа при
постоянном объеме будет равна:
. (4.6)
Если
газ нагревать при постоянном давление
(),
то полученное газом количество теплоты
расходуется на увеличение его внутренней
энергиии совершение газом работы:
.
Тогда
молярная теплоемкость идеального газа
при постоянном давлении определяется
следующим образом:
. (4.7)
Используя
уравнение состояния идеального газа
(уравнение Клапейрона–Менделеева),
можно показать, что для одного моля газа
справедливо соотношение:
,
поэтому:
.
Последнее выражение
называют уравнением Майера. Из него,
учитывая (4.6), получаем:
. (4.8)
Отношение
теплоемкостейобозначаюти называют показателем адиабаты или
коэффициентом Пуассона:
. (4.9)
Адиабатным
называется процесс, протекающий в
термоизолированной системе, т.е. без
теплообмена с окружающей средой,.
На
практике он может быть осуществлен в
системе, окруженной теплоизоляционной
оболочкой, но поскольку для теплообмена
необходимо некоторое время, то адиабатным
можно считать также процесс, который
протекает так быстро, что система не
успевает вступить в теплообмен с
окружающей средой.
Первый
закон термодинамики для адиабатного
процесса имеет вид.
Знак минус говорит о том, что при
адиабатном процессе система может
совершать работу только за счет внутренней
энергии. С учетом (4.4)–(4.6) имеем:
. (4.10)
Продифференцировав
уравнение Клапейрона–Менделеева,
получим:
.
Выразим
из негои подставим в формулу (4.10):
.
Выразивиз уравнения Майера и учитывая соотношение
(4.8), получим:
.
Интегрируя
данное дифференциальное уравнение при
условииполучим выражение:
.
(4.11)
Уравнение
(4.11) называется уравнением адиабаты или
уравнением Пуассона.
Метод
определения показателя адиабаты,
предложенный Клеманом и Дезормом (1819
г.), основывается на изучении параметров
некоторой массы газа, переходящей из
одного состояния в другое двумя
последовательными процессами –
адиабатным и изохорным. Эти процессы
на диаграмме–(рис. 4.1) изображены кривыми соответственно
1–2 и 2–3.
Если
в сосуд, соединенный с дифференциальным
датчиком давления, накачать воздух и
подождать до установления теплового
равновесия с окружающей средой, то в
этом начальном состоянии 1 газ имеет
параметры,,,
причем температура газа в сосуде равна
температуре окружающей среды,
а давлениенемного больше атмосферного.
Если
теперь на короткое время соединить
сосуд с атмосферой, то произойдет
адиабатное расширение воздуха. При этом
воздух в сосуде перейдет в состояние
2, его давление понизится до атмосферного.
Масса воздуха, оставшегося в сосуде,
которая в состоянии 1 занимала часть
объема сосуда, расширяясь, займет весь
объем.
При этом температура воздуха, оставшегося
в сосуде, понизится до.
Поскольку процесс 1–2 – адиабатный, к
нему можно применить уравнение Пуассона
(4.11):
или.
Отсюда:
. (4.12)
После
кратковременного соединения сосуда с
атмосферой охлажденный из-за адиабатного
расширения воздух в сосуде будет
нагреваться (процесс 2–3) до температуры
окружающей средыпри постоянном объеме.
При этом давление в сосуде поднимется
до.
Поскольку
процесс 2–3 – изохорный, к нему можно
применить закон Шарля:
или
. (4.13)
Из уравнений (4.12)
и (4.13) получим:
.
Прологарифмируем
это выражение:
.
Поскольку
избыточные давленияиочень малы по сравнению с атмосферным
давлением,
а также учитывая, что при,
будем иметь:
.
Откуда:
. (4.14)
Избыточные
давленияиизмеряют с помощью дифференциального
датчика давления.
Теплоемкости при постоянном давлении и постоянном объеме
При сообщении телу некоторого количества теплоты изменяется его температура (за исключением агрегатных превращений и вообще изотермических процессов). Характеристиками такого изменения являются различные теплоемкости: теплоемкость тела CT, удельная теплоемкость вещества c, молярная теплоемкость C.
Понятия теплоемкости тела и удельной теплоемкости рассмотрены тут.
Молярная теплоемкость C — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
Единицей молярной теплоемкости в СИ является джоуль на моль-Кельвин (Дж/моль·К).
Удельная теплоемкость связана с молярной соотношением
В отличие от такой, например, характеристики вещества, как его молекулярная масса Mr удельная теплоемкость вещества не является неизменным параметром. Удельная теплоемкость может резко изменяться при переходе вещества из одного агрегатного состояния в другое. Так, вода в газообразном состоянии имеет удельную теплоемкость 2,2·10 3 Дж/кг·К а в жидком 4,19·10 3 Дж/кг·К .
Теплоемкость зависит и от условий, при которых происходит передача теплоты телу. Последнее особенно относится к газам. Например, при изотермическом расширении газа ему передается некоторое количество теплоты Q > 0, а ΔΤ = 0. Следовательно, удельная теплоемкость газа при изотермическом процессе
При адиабатном сжатии (расширении) газ не получает теплоты и не передает ее окружающим телам (Q = 0), а температура газа изменяется (ΔΤ ≠ 0). Следовательно, удельная теплоемкость газа при адиабатном процессе
Наибольший интерес представляет теплоемкость для случаев, когда нагревание происходит при постоянном объеме или при постоянном давлении. В первом случае теплоемкость называется теплоемкостью при постоянном объеме или изохорной теплоемкостью (cV, CV), во втором — теплоемкостью при постоянном давлении или изобарной теплоемкостью (cp, Cp).
Если объем не изменяется (ΔV = 0), то работа, совершенная газом, так же равна нулю (А = 0). Согласно первому закону термодинамики
\Delta U = C_ \cdot \Delta T = c_V m \Delta T . \qquad (2)\)
Следовательно, теплоемкость при постоянном объеме равна изменению внутренней энергии газа при изменении температуры на 1 К.
Если газ идеальный, то в формуле (2)
\Delta U = \frac i2 \frac mM R \Delta T .\)
Тогда молярная теплоемкость при постоянном объеме \(
\Delta U_M = \frac i2 R \Delta T\) — изменение внутренней энергии 1 моль газа. Из этих равенств теплоемкость газа при постоянном объеме — \(
C_ = \frac i2 \frac mM R\); молярная теплоемкость газа при постоянном объеме — \(
Если газ нагревается при постоянном давлении, то согласно первому закону термодинамики
A = p \Delta V = \frac mM R \Delta T\).
Тогда теплоемкость газа при постоянном давлении
C_ = \frac = \frac + \frac mM R = C_ + \frac mM R = \frac \frac mM R .\)
Молярная теплоемкость при постоянном давлении:
C_p = C_V + R\) — уравнение Майера; \(
C_p = \frac i2 R + R = \frac R .\)
Таким образом, теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме. Их отношение равно
где γ — показатель адиабаты (коэффициент Пуассона).
Из-за малости величины коэффициента объемного расширения твердых и жидких тел работой, совершаемой ими при нагревании при постоянном давлении, можно пренебречь и считать, что теплоемкости при постоянном объеме и постоянном давлении практически совпадают. Поэтому теплоемкость твердых и жидких тел при заданной температуре может считаться вполне определенной величиной.
Удельная теплоемкость газов
Рубрики: физика | Теги: Удельная теплоемкость газов, физика | 5 августа 2014 | Svetlana
Сравните ваше решение задачи 8 с экспериментальным значением удельной теплоемкости гелия, равным 0,74 г. Предсказания и эксперимент согласуются очень хорошо. Измеряемое значение одно и то же при всех температурах, как это следует из вычислений. Следовательно, наша теория хорошо оправдывается.
Найдем теперь аналогичные данные для водорода. Если вместо 4 иг гелия мы возьмем 2 кг водорода в этом же объеме, то получим, что удельная теплоемкость должна быть около 1,5. Экспериментальное значение совершенно другое — около 2,5. Таким образом, наша теория продержалась недолго. Это расхождение оказывается полезным для новой теории. Получаемое из статистической механики равномерное распределение энергии в общем случае касается не только кинетической энергии движения. Оно утверждает только, что «средняя кинетическая энергия у всех молекул одинакова».
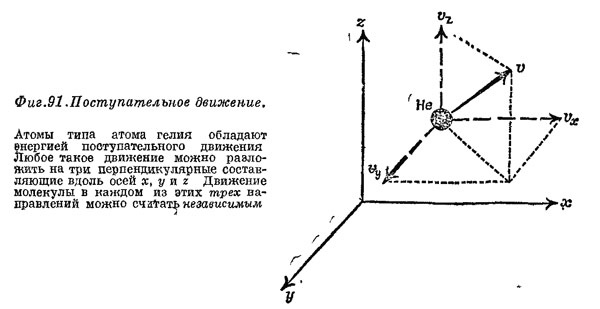
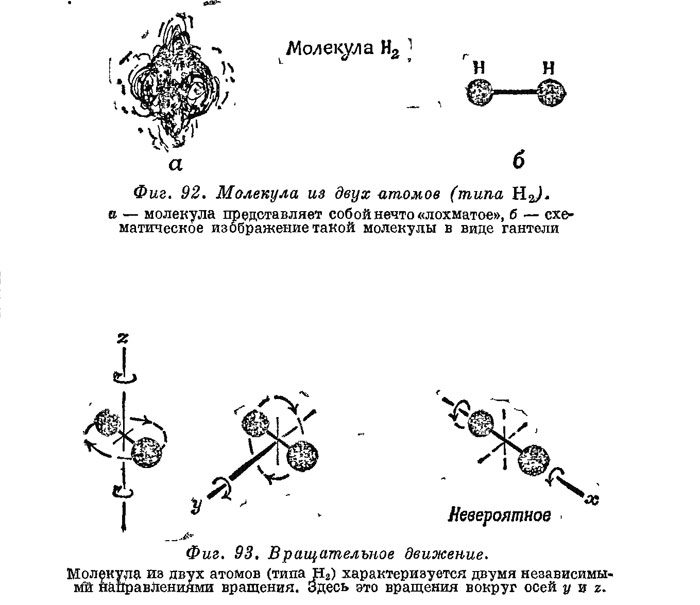
Оно поровну наделяет энергией все независимые типы, движений молекулы. Для атомов гелия, которые мы представляли в виде крошечных круглых шариков, хаотическое движение можно разбить на три независимые компоненты: движение вверх — вниз, вперед — назад и влево — вправо в направлениях х, у и z. Это — поступательное движение молекул, поэтому энергию его мы называем поступательной кинетической энергией. Равномерное распределение энергии говорит нам, что энергия в среднем складывается из трех равных долей поступательного движения. Сумма этих трех долей должна давать полную кинетическую энергию, которая равна 3/2 РV. Следовательно, на каждую долю поступательной энергии приходится 1/2 PV. Но в молекулу водорода входят два атома Н—Н, и она, кроме Того что движется как целое, может еще вращаться наподобие гантели (фиг» 63), т, е. обладать и вращательной энергией. У такой гантели, вообще говоря, имеются три независимые оси вращения. Однако вращение вокруг третьей оси (оси гантели) возбудить при соударениях слишком трудно. Таким образом, необходимо учитывать две доли вращательной энергии, кроме трех долей поступательной, каждая из которых равна 1/2 PV. Следовательно, при расчете теплоемкости водорода надо иметь в виду, что теплота расходуется на увеличение не только поступательной,, но и вращательной энергии, т. е. вместо трех долей нужно учитывать пять. Его удельная теплоемкость поэтому должна быть в 5/3 раза больше наших предсказаний, 5/3 (1,5)=2,5, тогда согласие о экспериментальным результатом 2,40 оказывается очень хорошим.

Автор Эрик Роджерс
Физика для любознательных”
ДРУГИЕ НАШИ ПРОЕКТЫ
Таблица удельной теплоемкости пищевых продуктов
В таблице приведены значения средней удельной теплоемкости пищевых продуктов (овощей, фруктов, мяса, рыбы, хлеба, вина и т. д.) в диапазоне температуры 5…20°С и нормальном атмосферном давлении.
| Продукты | C, Дж/(кг·К) |
|---|---|
| Абрикосы | 3770 |
| Ананасы | 3684 |
| Апельсины | 3730 |
| Арбуз | 3940 |
| Баклажаны | 3935 |
| Брюква | 3810 |
| Ветчина | 2140 |
| Вино крепленое | 3690 |
| Вино сухое | 3750 |
| Виноград | 3550 |
| Вишня | 3650 |
| Говядина и баранина жирная | 2930 |
| Говядина и баранина маложирная | 3520 |
| Горох | 3684 |
| Грибы свежие | 3894 |
| Груши | 3680 |
| Дрожжи прессованные | 1550…3516 |
| Дыни | 3850 |
| Ежевика | 3642 |
| Земляника | 3684 |
| Зерно пшеничное | 1465…1549 |
| Кабачки | 3900 |
| Капуста | 3940 |
| Картофель | 3430 |
| Клубника | 3810 |
| Колбасы | 1930…2810 |
| Крыжовник | 3890 |
| Лимоны | 3726 |
| Лук | 2638 |
| Макароны не приготовленные | 1662 |
| Малина | 3480 |
| Мандарины | 3770 |
| Маргарин сливочный | 2140…3182 |
| Масло анисовое | 1846 |
| Масло мятное | 2080 |
| Масло сливочное | 2890…3100 |
| Масло сливочное топленое | 2180 |
| Мед | 2300…2428 |
| Молоко сухое | 1715…2090 |
| Морковь | 3140 |
| Мороженое (при -10С) | 2175 |
| Мука | 1720 |
| Огурцы | 4060 |
| Пастила | 2090 |
| Патока | 2512…2700 |
| Перец сладкий | 3935 |
| Печенье | 2170 |
| Помидоры | 3980 |
| Пряники | 1800…1930 |
| Редис | 3970 |
| Рыба жирная | 2930 |
| Рыба нежирная | 3520 |
| Салат зеленый | 4061 |
| Сало топленое | 2510 |
| Сахар кусковой | 1340 |
| Сахарный песок | 720 |
| Свекла | 3340 |
| Свинина жирная | 260 |
| Свинина нежирная | 3010 |
| Слива | 3750 |
| Сметана | 3010 |
| Смородина черная | 3740 |
| Сода | 2256 |
| Соль поваренная (2% влажности) | 920 |
| Спаржа | 3935 |
| Сыр жирный | 2430 |
| Творог | 3180 |
| Телятина жирная | 3180 |
| Телятина нежирная | 3520 |
| Тесто заварное | 2910 |
| Тыква | 3977 |
| Хлеб (корка) | 1680 |
| Хлеб (мякиш) | 2800 |
| Черешня | 3770 |
| Чернослив | 3181 |
| Чеснок | 3140 |
| Шоколад | 2340…2970 |
| Шпинат | 3977 |
| Яблоки | 3760 |
| Яйцо куриное | 3180 |
Кроме таблиц удельной теплоемкости, вы также можете ознакомиться с подробнейшей таблицей плотности веществ и материалов, которая содержит данные по величине плотности более 500 веществ (металлов, пластика, резины, продуктов, стекла и др.).
Источник
Виды теплопередачи
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Таблица удельной теплоемкости пищевых продуктов
В таблице приведены значения средней удельной теплоемкости пищевых продуктов (овощей, фруктов, мяса, рыбы, хлеба, вина и т. д.) в диапазоне температуры 5…20°С и нормальном атмосферном давлении.
| Продукты | C, Дж/(кг·К) |
|---|---|
| Абрикосы | 3770 |
| Ананасы | 3684 |
| Апельсины | 3730 |
| Арбуз | 3940 |
| Баклажаны | 3935 |
| Брюква | 3810 |
| Ветчина | 2140 |
| Вино крепленое | 3690 |
| Вино сухое | 3750 |
| Виноград | 3550 |
| Вишня | 3650 |
| Говядина и баранина жирная | 2930 |
| Говядина и баранина маложирная | 3520 |
| Горох | 3684 |
| Грибы свежие | 3894 |
| Груши | 3680 |
| Дрожжи прессованные | 1550…3516 |
| Дыни | 3850 |
| Ежевика | 3642 |
| Земляника | 3684 |
| Зерно пшеничное | 1465…1549 |
| Кабачки | 3900 |
| Капуста | 3940 |
| Картофель | 3430 |
| Клубника | 3810 |
| Колбасы | 1930…2810 |
| Крыжовник | 3890 |
| Лимоны | 3726 |
| Лук | 2638 |
| Макароны не приготовленные | 1662 |
| Малина | 3480 |
| Мандарины | 3770 |
| Маргарин сливочный | 2140…3182 |
| Масло анисовое | 1846 |
| Масло мятное | 2080 |
| Масло сливочное | 2890…3100 |
| Масло сливочное топленое | 2180 |
| Мед | 2300…2428 |
| Молоко сухое | 1715…2090 |
| Морковь | 3140 |
| Мороженое (при -10С) | 2175 |
| Мука | 1720 |
| Огурцы | 4060 |
| Пастила | 2090 |
| Патока | 2512…2700 |
| Перец сладкий | 3935 |
| Печенье | 2170 |
| Помидоры | 3980 |
| Пряники | 1800…1930 |
| Редис | 3970 |
| Рыба жирная | 2930 |
| Рыба нежирная | 3520 |
| Салат зеленый | 4061 |
| Сало топленое | 2510 |
| Сахар кусковой | 1340 |
| Сахарный песок | 720 |
| Свекла | 3340 |
| Свинина жирная | 260 |
| Свинина нежирная | 3010 |
| Слива | 3750 |
| Сметана | 3010 |
| Смородина черная | 3740 |
| Сода | 2256 |
| Соль поваренная (2% влажности) | 920 |
| Спаржа | 3935 |
| Сыр жирный | 2430 |
| Творог | 3180 |
| Телятина жирная | 3180 |
| Телятина нежирная | 3520 |
| Тесто заварное | 2910 |
| Тыква | 3977 |
| Хлеб (корка) | 1680 |
| Хлеб (мякиш) | 2800 |
| Черешня | 3770 |
| Чернослив | 3181 |
| Чеснок | 3140 |
| Шоколад | 2340…2970 |
| Шпинат | 3977 |
| Яблоки | 3760 |
| Яйцо куриное | 3180 |
Кроме таблиц удельной теплоемкости, вы также можете ознакомиться с подробнейшей таблицей плотности веществ и материалов, которая содержит данные по величине плотности более 500 веществ (металлов, пластика, резины, продуктов, стекла и др.).
Источник
Удельная теплоёмкость

удельная теплоёмкость, удельная теплоёмкость 8 классУде́льная теплоёмкость — отношение теплоёмкости к массе, теплоёмкость единичной массы вещества (разная для различных веществ); физическая величина, численно равная количеству теплоты, которое необходимо передать единичной массе данного вещества для того, чтобы его температура изменилась на единицу.
В Международной системе единиц (СИ) удельная теплоёмкость измеряется в джоулях на килограмм на кельвин, Дж/(кг·К). Иногда используются и внесистемные единицы: калория/(кг·К) и т.д.
Удельная теплоёмкость обычно обозначается буквами c или С, часто с индексами.
На значение удельной теплоёмкости влияет температура вещества и другие термодинамические параметры. К примеру, измерение удельной теплоёмкости воды даст разные результаты при 20 °C и 60 °C.
Кроме того, удельная теплоёмкость зависит от того, каким образом позволено изменяться термодинамическим параметрам вещества (давлению, объёму и т. д.
); например, удельная теплоёмкость при постоянном давлении (CP) и при постоянном объёме (CV), вообще говоря, различны.
Формула расчёта удельной теплоёмкости: где c — удельная теплоёмкость, Q — количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении), m — масса нагреваемого (охлаждающегося) вещества, ΔT — разность конечной и начальной температур вещества. Удельная теплоёмкость может зависеть (и в принципе, строго говоря, всегда — более или менее сильно — зависит) от температуры, поэтому более корректной является следующая формула с малыми (формально бесконечно малыми) и :
- 1 Значения удельной теплоёмкости некоторых веществ
- 2 См. также
- 3 Примечания
- 4 Литература
- 5 Ссылки
Значения удельной теплоёмкости некоторых веществ
| воздух (сухой) | газ | 1,005 |
| воздух (100 % влажность) | газ | 1,0301 |
| алюминий | твёрдое тело | 0,903 |
| бериллий | твёрдое тело | 1,8245 |
| латунь | твёрдое тело | 0,377 |
| олово | твёрдое тело | 0,218 |
| медь | твёрдое тело | 0,385 |
| молибден | твёрдое тело | 0,250 |
| сталь | твёрдое тело | 0,462 |
| алмаз | твёрдое тело | 0,502 |
| этанол | жидкость | 2,460 |
| золото | твёрдое тело | 0,129 |
| графит | твёрдое тело | 0,720 |
| гелий | газ | 5,190 |
| водород | газ | 14,300 |
| железо | твёрдое тело | 0,444 |
| свинец | твёрдое тело | 0,130 |
| чугун | твёрдое тело | 0,540 |
| вольфрам | твёрдое тело | 0,134 |
| литий | твёрдое тело | 3,582 |
| ртуть | жидкость | 0,139 |
| азот | газ | 1,042 |
| нефтяные масла | жидкость | 1,67 — 2,01 |
| кислород | газ | 0,920 |
| кварцевое стекло | твёрдое тело | 0,703 |
| вода 373 К (100 °C) | газ | 2,020 |
| вода | жидкость | 4,187 |
| лёд | твёрдое тело | 2,060 |
| сусло пивное | жидкость | 3,927 |
| асфальт | 0,92 |
| полнотелый кирпич | 0,84 |
| силикатный кирпич | 1,00 |
| бетон | 0,88 |
| кронглас (стекло) | 0,67 |
| флинт (стекло) | 0,503 |
| оконное стекло | 0,84 |
| гранит | 0,790 |
| талькохлорит | 0,98 |
| гипс | 1,09 |
| мрамор, слюда | 0,880 |
| песок | 0,835 |
| сталь | 0,47 |
| почва | 0,80 |
| древесина | 1,7 |
См. также
- Теплоёмкость
- Объёмная теплоёмкость
- Молярная теплоёмкость
- Скрытая теплота
- Теплоёмкость идеального газа
- Удельная теплота парообразования и конденсации
- Удельная теплота плавления
Примечания
-
↑ Для неоднородного (по химическому составу) образца удельная теплоемкость является дифференциальной характеристикой , меняющейся от точки к точке.
Зависит она в принципе и от температуры (хотя во многих случаях изменяется достаточно слабо при достаточно больших изменениях температуры), при этом строго говоря определяется — вслед за теплоёмкостью — как дифференциальная величина и по температурной оси, т.е.
строго говоря следует рассматривать изменение температуры в определении удельной теплоёмкости не на один градус (тем более не на какую-то более крупную единицу температуры), а на малое с соответствующим количеством переданной теплоты . (См. далее основной текст).
- ↑ Кельвины (К) здесь можно заменять на градусы Цельсия (°C), поскольку эти температурные шкалы (абсолютная и шкала Цельсия) отличаются друг от друга лишь начальной точкой, но не величиной единицы измерения.
Ссылки
- Таблицы физических величин. Справочник, под ред. И. К. Кикоина, М., 1976.
- Сивухин Д. В. Общий курс физики. — Т. II. Термодинамика и молекулярная физика.
- E. М. Лифшиц Теплоёмкость // под. ред. А. М. Прохорова Физическая энциклопедия. — М.: «Советская энциклопедия», 1998. — Т. 2.
Рекомендации
- Открытый университет (2008 г.). S104 Книга 3 Энергия и свет, п. 59. Открытый университет. ISBN .
- Открытый университет (2008 г.). S104 Книга 3 Энергия и свет, п. 179. Открытый университет. ISBN .
- Справочник Ланге по химии, 10-е изд. стр. 1524
- Издается под эгидой Verein Deutscher Ingenieure (VDI).
- Фейнман Р. Лекции по физике. I, глава 40, стр. 7-8
- Чарльз Киттель; Герберт Кремер (2000). Теплофизика. Фримен. п. 78. ISBN 978-0-7167-1088-2.
- Стивен Т. Торнтон и Эндрю Рекс (1993): Современная физика для ученых и инженеров, Saunders College Publishing, 1993 г.
- М.В. Чейз-младший (1998) , В Журнал физических и химических справочных данных, Монография 9, страницы 1-1951.
- Ричард Фейнман, Лекции по физике, Том 1 (45)
- Юнус А. Ценгель и Майкл А. Боулс, Термодинамика: инженерный подход, 7-е издание, McGraw-Hill, 2010, ISBN 007-352932-X.
Таблица удельной теплоемкости пищевых продуктов
В таблице приведены значения средней удельной теплоемкости пищевых продуктов (овощей, фруктов, мяса, рыбы, хлеба, вина и т. д.) в диапазоне температуры 5…20°С и нормальном атмосферном давлении.
| Продукты | C, Дж/(кг·К) |
|---|---|
| Абрикосы | 3770 |
| Ананасы | 3684 |
| Апельсины | 3730 |
| Арбуз | 3940 |
| Баклажаны | 3935 |
| Брюква | 3810 |
| Ветчина | 2140 |
| Вино крепленое | 3690 |
| Вино сухое | 3750 |
| Виноград | 3550 |
| Вишня | 3650 |
| Говядина и баранина жирная | 2930 |
| Говядина и баранина маложирная | 3520 |
| Горох | 3684 |
| Грибы свежие | 3894 |
| Груши | 3680 |
| Дрожжи прессованные | 1550…3516 |
| Дыни | 3850 |
| Ежевика | 3642 |
| Земляника | 3684 |
| Зерно пшеничное | 1465…1549 |
| Кабачки | 3900 |
| Капуста | 3940 |
| Картофель | 3430 |
| Клубника | 3810 |
| Колбасы | 1930…2810 |
| Крыжовник | 3890 |
| Лимоны | 3726 |
| Лук | 2638 |
| Макароны не приготовленные | 1662 |
| Малина | 3480 |
| Мандарины | 3770 |
| Маргарин сливочный | 2140…3182 |
| Масло анисовое | 1846 |
| Масло мятное | 2080 |
| Масло сливочное | 2890…3100 |
| Масло сливочное топленое | 2180 |
| Мед | 2300…2428 |
| Молоко сухое | 1715…2090 |
| Морковь | 3140 |
| Мороженое (при -10С) | 2175 |
| Мука | 1720 |
| Огурцы | 4060 |
| Пастила | 2090 |
| Патока | 2512…2700 |
| Перец сладкий | 3935 |
| Печенье | 2170 |
| Помидоры | 3980 |
| Пряники | 1800…1930 |
| Редис | 3970 |
| Рыба жирная | 2930 |
| Рыба нежирная | 3520 |
| Салат зеленый | 4061 |
| Сало топленое | 2510 |
| Сахар кусковой | 1340 |
| Сахарный песок | 720 |
| Свекла | 3340 |
| Свинина жирная | 260 |
| Свинина нежирная | 3010 |
| Слива | 3750 |
| Сметана | 3010 |
| Смородина черная | 3740 |
| Сода | 2256 |
| Соль поваренная (2% влажности) | 920 |
| Спаржа | 3935 |
| Сыр жирный | 2430 |
| Творог | 3180 |
| Телятина жирная | 3180 |
| Телятина нежирная | 3520 |
| Тесто заварное | 2910 |
| Тыква | 3977 |
| Хлеб (корка) | 1680 |
| Хлеб (мякиш) | 2800 |
| Черешня | 3770 |
| Чернослив | 3181 |
| Чеснок | 3140 |
| Шоколад | 2340…2970 |
| Шпинат | 3977 |
| Яблоки | 3760 |
| Яйцо куриное | 3180 |
Кроме таблиц удельной теплоемкости, вы также можете ознакомиться с подробнейшей таблицей плотности веществ и материалов, которая содержит данные по величине плотности более 500 веществ (металлов, пластика, резины, продуктов, стекла и др.).
- Исаченко В. П., Осипова В. А., Сукомел А. С. Теплопередача. Учебник для вузов, изд. 3-е, перераб. и доп. — М.: «Энергия», 1975.
- Тепловые свойства металлов и сплавов. Справочник. Лариков Л. Н., Юрченко Ю. Ф. — Киев: Наукова думка, 1985. — 439 с.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др. Под ред. И. С. Григорьева — М.: Энергоатомиздат, 1991. — 1232 с.
- Еремкин А. И., Королева Т. И. Тепловой режим зданий: Учебное пособие. — М.: Издательство ACB, 2000 — 368 с.
- Кириллов П. Л., Богословская Г. П. Тепломассобмен в ядерных энергетических установках: Учебник для вузов.
- Михеев М. А., Михеева И. М. Основы теплопередачи. Изд. 2-е, стереотип. М.: «Энергия», 1977. — 344 с. с ил.
- Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Франчук А. У. Таблицы теплотехнических показателей строительных материалов, М.: НИИ строительной физики, 1969 — 142 с.
- Добрынин В. М., Вендельштейн Б. Ю., Кожевников Д. А. Петрофизика: Учеб. для вузов. 2-ое изд. перераб. и доп. под редакцией доктора физико-математических наук Д. А. Кожевникова — М.: ФГУП Издательство «Нефть и газ» РГУ нефти и газа им. И.М. Губкина, 2004. — 368 с., ил.
- В. Блази. Справочник проектировщика. Строительная физика. М.: Техносфера, 2005. — 536 с.
- Енохович А. С. Справочник по физике. М.: «Просвещение», 1978. — 415 с. с ил.
- Строительная теплотехника СНиП II-3-79. Минстрой России — Москва 1995.
- Мустафаев Р. А. Теплофизические свойства углеводородов при высоких параметрах состояния. М.: Энергоатомиздат, 1991. — 312 с.
- Новиченок Н. Л., Шульман З. П. Теплофизические свойства полимеров. Минск, «Наука и техника» 1971. — 120 с.
- Шелудяк Ю. Е., Кашпоров Л. Я. и др. Теплофизические свойства компонентов горючих систем. М., 1992. — 184 с.