Параметры состояния и функции состояния системы. параметры состояния газа
Содержание:
- Классический идеальный газ
- Теплоемкость газов
- Среднеквадратичная скорость
- Идеальные квантовые газы
- Определение 1-го закона термодинамики
- § 5. Уравнение состояния идеального газа
- Хранение и транспортировка газов
- Классический термодинамический идеальный газ
- Изобарный процесс (p=const)
- Изопроцессы
- Общее определение
- Давление
Классический идеальный газ
Попробуем представить молекулы идеального газа маленькими шариками, находящимися в огромном кубе на большом расстоянии друг от друга. Из-за этого расстояния они не могут друг с другом взаимодействовать. Следовательно, их потенциальная энергия равна нулю. Но эти шарики двигаются с огромной скоростью. А значит, обладают кинетической энергией. Когда они сталкиваются друг с другом и со стенками куба, они ведут себя как мячики, то есть упруго отскакивают. При этом они меняют направление своего движения, но не меняют скорости. Примерно так выглядит движение молекул в идеальном газе.
Газ можно считать идеальным, если в нём выполняются следующие допущения:
- Потенциальная энергия взаимодействия молекул идеального газа настолько мала, что ею пренебрегают по сравнению с кинетической энергией.
- Молекулы в идеальном газе также имеют настолько маленькие размеры, что их можно считать материальными точками. А это означает, что и их суммарный объём также ничтожно мал по сравнению с объёмом сосуда, в котором находится газ. И этим объёмом также пренебрегают.
- Среднее время между столкновениями молекул намного превышает время их взаимодействия при соударении. Поэтому временем взаимодействия пренебрегают также.
Газ всегда принимает форму сосуда, в котором находится. Движущиеся частицы сталкиваются друг с другом и со стенками сосуда. Во время удара каждая молекула действует на стенку с некоторой силой в течение очень короткого промежутка времени. Так возникает давление. Суммарное давление газа складывается из давлений всех молекул.
Теплоемкость газов
При
проведении тепловых расчетов газопроводов
необходимо знать значение удельных
теплоемкостей газов. Удельной теплоемкостью
газа называется количество тепла,
которое необходимо сообщить единице
массы (или объема) газа, чтобы температура
его в данном процессе изменилась на 1°
С.
Теплоемкость
газа зависит от характера протекаемого
процесса. Например, если в газгольдере
находится газ, который подогревается
на 1°С, но при этом в различных случаях
объем газа меняется по-разному. Работа
газа будет различной. В связи с этим и
теплоемкость газа будет не одинакова.
Она будет зависеть от характера
протекающего процесса.
Наибольшее
распространение в термодинамических
расчетах получили теплоемкости двух
простейших процессов: при постоянном
давлении Сри
при постоянном объеме Сv.
В
каком-либо определенном процессе
изменения состояния газа количество
тепла, необходимое для нагревания 1 кг
газа на 1°С при данном давлении, зависит
от абсолютной температуры газа. Количество
тепла оказывается разным при различных
температурах газа. При данной температуре
газа количество тепла, необходимое для
нагревания 1 кг газа на 1°С, зависит от
величины давления.
Для городских
газопроводов теплоемкость газов
изменяется в узких пределах, поэтому
величину теплоемкости можно принимать
постоянной.
Значения
массовой теплоемкости Срнекоторых
газов (в кДж/(кг∙К):
При
При
0°С
100°С
Бутан……….1,592 2,021
Воздух………1,003 1.010
Метан……….2,165 2.448
Пропан………1,549 2,016
В табл. 7.2 приведены
значения массовой теплоемкости при
постоянном давлении для метана в
зависимости от давления и температуры.
Для идеальных газов справедливо
соотношение (закон Майера):
(7.10)
гдеср—
удельная теплоемкость при постоянном
давлении в Дж/(кг∙К); сυ
— удельная теплоемкость при постоянном
объеме в Дж/(кг∙К); R—
газовая постоянная в Дж/(кг∙К).
Таким
образом, если известна величина удельной
теплоемкости при постоянном давлении,
можно определить теплоемкость при
постоянном объеме.
Массовые удельные
теплоемкости при постоянном давлении
и постоянном объеме идеальных газов
являются функцией только одной
температуры, т. е. зависят только от
температуры.
Таблица 7.2
Массовые
теплоемкости Ср(в
кДж/(кг∙К)
метана при постоянном давлении
-
Температура,
°СДавление, МПа
0,0980
1,010
2,020
3,030
4,040
-30
-20
-10
0,0
+10
+20
+30
2,022
2,064
2,110
2,152
2,192
2,231
2,273
2.106
2,148
2,185
2,223
2,261
2,298
2,336
2,223
2,244
2,269
2,307
2,340
2,378
2,407
2,370
2,360
2,370
2,395
2.424
2,457
2,483
2,554
2,499
2,487
2,491
2,512
2,537
2,554
Среднеквадратичная скорость
Потенциальной энергией молекул газа пренебречь можно, а вот кинетической — никак нельзя. Потому что кинетическая энергия — это энергия движения, а мы не можем пренебрегать скоростью движения молекул.
На графике показано распределение Максвелла — то, как молекулы распределяются по скоростям. Судя по графику, большинство молекул движутся со средним значением скорости. Хотя есть и быстрые, и медленные молекулы, просто их значительно меньше.

Но наш газ идеальный, а в идеальном газе случаются чудеса. Одно из таких чудес — то, что все молекулы идеального газа двигаются с одинаковой скоростью. Эта скорость называется средней квадратичной.
|
Средняя квадратичная скорость v1, v2, vn — скорости разных молекул [м/с] N — количество молекул |
Идеальные квантовые газы
В вышеупомянутом уравнении Сакура – Тетроде лучший выбор константы энтропии оказался пропорциональным квантовой тепловой длине волны частицы, а точка, в которой аргумент логарифма обращается в ноль, примерно равна точке при при котором среднее расстояние между частицами становится равным тепловой длине волны. Фактически, сама квантовая теория предсказывает то же самое. Любой газ ведет себя как идеальный газ при достаточно высокой температуре и достаточно низкой плотности, но в точке, где уравнение Сакура – Тетрода начинает разрушаться, газ начинает вести себя как квантовый газ, состоящий либо из бозонов, либо из фермионов . (См. Статью о газе в рамке для получения информации об идеальных квантовых газах, включая идеальный газ Больцмана.)
Когда температура достигает температуры Бойля, газы имеют тенденцию вести себя как идеальный газ в более широком диапазоне давлений .
Идеальный газ Больцмана
Идеальный газ Больцмана дает те же результаты, что и классический термодинамический газ, но делает следующую идентификацию для неопределенной постоянной Φ :
- Φзнак равноТ32Λ3г{\ displaystyle \ Phi = {\ frac {T ^ {\ frac {3} {2}} \ Lambda ^ {3}} {g}}}
где Λ — тепловая длина волны де Бройля газа, а g — вырождение состояний.
Идеальные бозе- и ферми-газы
Идеальный газ бозонов (например, фотонный газ ) будет регулироваться статистикой Бозе – Эйнштейна, а распределение энергии будет иметь форму распределения Бозе – Эйнштейна . Идеальный газ фермионов будет определяться статистикой Ферми – Дирака, а распределение энергии будет иметь форму распределения Ферми – Дирака .
Определение 1-го закона термодинамики
Первый закон термодинамики представляет собой некое обобщение закона сохранения и превращения энергии для термодинамической системы, и формулируется следующим образом:
∆U=Q-A.
Определение 1
Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
Формула первого закона термодинамики, зачастую записывается в ином виде:
Q=∆U+A.
Определение 2
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Первый закон термодинамики представляет из себя, по сути, обобщение опытных фактов. Если руководствоваться им, то можно заявить, что энергия не возникает и не исчезает бесследно, а передается от одной системы к другой, меняя свои формы. Невозможность создания вечного двигателя (perpetuum mobile) первого рода, то есть машины, которая может совершать полезную работу, не потребляя энергию извне и не претерпевая каких-либо изменений во внутренней конструкции агрегата, являлась важным следствием первого закона термодинамики. В подтверждение этого выступает тот факт, что каждая из огромного множества попыток создания такого устройства неизменно заканчивалась неудачей. Реальная машина может совершать положительную работу A над внешними объектами, только получая некоторое количество теплоты Q от окружающих тел или уменьшая ΔU своей внутренней энергии.
§ 5. Уравнение состояния идеального газа
Выясним, как связаны между собой макроскопические параметры идеального газа, которые характеризуют его равновесное состояние: давление, масса всего газа, объём, предоставленный ему, и температура.
Состояние макроскопической системы полностью определено, если известны её макроскопические параметры — давление , масса , температура и объём . Уравнение, связывающее параметры данного состояния, называют уравнением состояния системы. Изменение параметров состояния системы с течением времени называют процессом.
Если при переходе идеального газа из одного состояния в другое число его молекул остаётся постоянным, т. е. масса и молярная масса газа не изменяются, то из уравнений и следует:
, ,
(5.1)
где — постоянная Больцмана; — параметры начального состояния газа, а — конечного. Из соотношений (5.1) следует, что
,
или
.
(5.2)
При неизменных массе и молярной массе идеального газа отношение произведения его давления и объёма к абсолютной температуре является величиной постоянной.
Уравнение (5.2) связывает два рассматриваемых состояния идеального газа независимо от того, каким образом газ перешёл из одного состояния в другое.
Уравнение состояния в виде (5.2) впервые вывел в 1834 г. французский физик Бенуа Клапейрон (1799–1864), поэтому его называют уравнением Клапейрона.
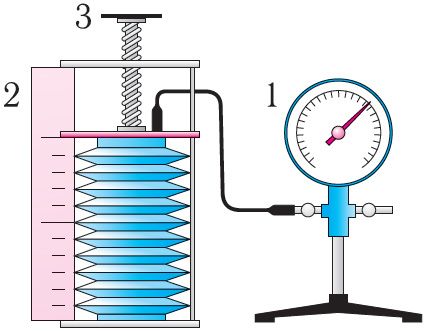 Рис. 18
Рис. 18
В справедливости уравнения состояния можно убедиться, воспользовавшись установкой, изображённой на рисунке 18. Манометром 1, соединённым с герметичным гофрированным сосудом, регистрируют давление газа внутри сосуда. Объём газа в сосуде можно рассчитать, используя линейку 2. Температура газа в сосуде равна температуре окружающей среды и может быть измерена термометром.
Измерив параметры газа в начальном состоянии, вычисляют отношение . Затем помещают сосуд в горячую воду. При этом температура газа и его давление изменяются. Вращая винт 3, изменяют вместимость сосуда. Измерив снова давление газа и температуру , а также рассчитав предоставленный ему объём , вычисляют отношение Как показывают расчёты, уравнение состояния (5.2) выполняется в пределах погрешности эксперимента.
Уравнение состояния (5.2) можно применять для газов при следующих условиях:
1) не очень большие давления (пока собственный объём всех молекул газа пренебрежимо мал по сравнению с предоставленным ему объёмом);
2) не слишком низкие или же высокие температуры (пока абсолютное значение потенциальной энергии межмолекулярного взаимодействия пренебрежимо мало по сравнению с кинетической энергией теплового движения молекул).
От теории к практике
Рис. 19
На рисунке 19 представлен график процесса перехода идеального газа данной массы из состояния 1 в состояние 2. Как изменился объём газа в результате этого процесса?
Поскольку число частиц , то из уравнения (5.1) следует:
.
(5.3)
Величину, равную произведению постоянной Больцмана и постоянной Авогадро , назвали универсальной газовой постоянной :
.
(5.4)
С учётом выражения (5.4) уравнение (5.3) примет вид:
.
(5.5)
Поскольку количество вещества , то формулу (5.5) можно записать в виде:
.
Уравнение состояния в виде (5.5) впервые получил русский учёный Д. И. Менделеев (1834–1907) в 1874 г., поэтому его называют уравнением Клапейрона–Менделеева.
Отметим, что уравнение Клапейрона–Менделеева связывает между собой макроскопические параметры конкретного состояния идеального газа. Используя уравнение Клапейрона–Менделеева, можно описать различные процессы, происходящие в идеальном газе.
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое или если газ необходимо длительно хранить, его помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или пытаться сделать в них отверстие — даже после использования.
Классический термодинамический идеальный газ
Классические термодинамические свойства идеального газа можно описать двумя уравнениями состояния :
Закон идеального газа
Связь между законами Бойля , Шарля , Гей-Люссака , Авогадро , комбинированного и идеального газа с постоянной Больцмана k B =рN A знак равно п RN (в каждом законе свойства, обведенные кружком, являются переменными, а свойства, не обведенные кружком, считаются постоянными)
Закон идеального газа — это уравнение состояния идеального газа, которое определяется следующим образом:
куда
- P — давление
- V — объем
- n — количество вещества в газе (в молях )
- R — газовая постоянная (0,08206 л · атм · K −1 · моль −1 )
- Т — абсолютная температура .
Закон идеального газа — это расширение экспериментально обнаруженных законов газа . Это также может быть получено из микроскопических соображений.
Реальные жидкости при низкой плотности и высокой температуре приблизительно соответствуют поведению классического идеального газа. Однако при более низких температурах или более высокой плотности реальная жидкость сильно отличается от поведения идеального газа, особенно когда она конденсируется из газа в жидкость или осаждается из газа в твердое тело. Это отклонение выражается коэффициентом сжимаемости .
Это уравнение получено из
- Закон Бойля : ;V∝1п{\ displaystyle V \ propto {\ frac {1} {P}}}
- Закон Чарльза : ;V∝Т{\ Displaystyle V \ propto T}
- Закон Авогадро : .V∝п{\ Displaystyle V \ propto n}
Объединив три закона, получим
- V∝пТп{\ displaystyle V \ propto {\ frac {nT} {P}}}
Это:
- Vзнак равнор(пТп){\ displaystyle V = R \ left ({\ frac {nT} {P}} \ right)}
- пVзнак равнопрТ{\ displaystyle PV = nRT}.
Внутренняя энергия
Другое уравнение состояния идеального газа должно выражать , согласно которому внутренняя энергия фиксированной массы идеального газа является функцией только его температуры. Для наших целей удобно постулировать примерную версию этого закона, написав:
- Uзнак равноc^VпрТ{\ displaystyle U = {\ hat {c}} _ {V} nRT}
куда
- U — внутренняя энергия
- ĉ V — безразмерная удельная теплоемкость при постоянном объеме, приблизительно32для одноатомного газа ,52для двухатомного газа и 3 для нелинейных молекул, если рассматривать трансляции и вращения классически и игнорировать квантовый колебательный вклад и электронное возбуждение. Эти формулы возникают в результате применения классической теоремы о равнораспределении к поступательным и вращательным степеням свободы.
То, что U для идеального газа зависит только от температуры, является следствием закона идеального газа, хотя в общем случае ĉ V зависит от температуры, и для вычисления U необходим интеграл .
Микроскопическая модель
Чтобы перейти от макроскопических величин (левая часть следующего уравнения) к микроскопическим (правая часть), мы используем
- прзнак равноNkB{\ displaystyle nR = Nk _ {\ mathrm {B}}}
куда
- N{\ displaystyle N} количество частиц газа
- kB{\ Displaystyle к _ {\ mathrm {B}}}- постоянная Больцмана (1,381 × 10 −23 Дж · К −1 ).
Распределение вероятностей частиц по скорости или энергии дается распределением скорости Максвелла .
Модель идеального газа зависит от следующих предположений:
- Молекулы газа неразличимы, маленькие, твердые сферы.
- Все столкновения упругие, и любое движение происходит без трения (без потерь энергии при движении или столкновении)
- Применяются законы Ньютона
- Среднее расстояние между молекулами намного больше, чем размер молекул.
- Молекулы постоянно движутся в случайных направлениях с распределением скоростей
- Между молекулами нет сил притяжения или отталкивания, кроме тех, которые определяют их точечные столкновения.
- Единственные силы между молекулами газа и окружающей средой — это те, которые определяют точечные столкновения молекул со стенками.
- В простейшем случае нет дальнодействующих сил между молекулами газа и окружающей средой.
Предположение о сферических частицах необходимо для того, чтобы не было разрешенных вращательных мод, в отличие от двухатомного газа. Следующие три предположения очень взаимосвязаны: молекулы твердые, столкновения упругие, межмолекулярные силы отсутствуют. Предположение о том, что пространство между частицами намного больше, чем сами частицы, имеет первостепенное значение и объясняет, почему приближение идеального газа не работает при высоких давлениях.
Изобарный процесс (p=const)
Определение 15
Изобарный процесс – это квазистатический процесс, протекающий с постоянным параметром p.
Уравнение такого состояния с неизменным количеством вещества ν запишется как
VT=const или V=VαT, где V — объем газа при температуре °C. Температурный коэффициент объемного расширения газов равняется α=1273,15К-1.
Рисунок 3.3.5. Модель изобарного процесса.
Изобарные процессы плоскости (V, T) имеют разные значения p и изображены прямыми линиями (изобарами), изображенными на рисунке 3.3.6.
Рисунок 3.3.6. Семейство изобар на плоскости (V, T). p3>p2>p1.
Определение 16
Данное уравнение с зависимостью параметра V от T с неизменным давлением довелось исследовать Ж. Гей-Люссаку в 1862 году. Оно получило название закона Гей-Люссака.
Законы Бойла-Мариотта, Шарля и Гей-Люссака объясняются с помощью молекулярно-кинетической теории газов, так как являются следствиями уравнения состояния идеального газа.
Всё ещё сложно?
Наши эксперты помогут разобраться
Все услуги
Решение задач
от 1 дня / от 150 р.
Курсовая работа
от 5 дней / от 1800 р.
Реферат
от 1 дня / от 700 р.
Изопроцессы
С помощью уравнения объединённого газового закона можно исследовать процессы, в которых масса газа и один из важнейших параметров — давление, температура или объём — остаются постоянными. В физике такие процессы называются изопроцессами.
Из объединённого газового закона вытекают другие важнейшие газовые законы: закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, или второй закон Гей-Люссака.
Изотермический процесс
Процесс, в котором изменяются давление или объём, но температура остаётся постоянной, называется изотермическим процессом.
При изотермическом процессе T = const, m = const.
Поведение газа в изотермическом процессе описывает закон Бойля-Мариотта. Этот закон открыли экспериментальным путём английский физик Роберт Бойль в 1662 г. и французский физик Эдм Мариотт в 1679 г. Причём сделали они это независимо друг от друга. Закон Бойля-Мариотта формулируется следующим образом: В идеальном газе при постоянной температуре произведение давления газа на его объём также постоянно.
Уравнение Бойля-Мариотта можно вывести из объединённого газового закона. Подставив в формулу Т = const,получаем
p·V = const
Это и есть закон Бойля-Мариотта. Из формулы видно, что давление газа при постоянной температуре обратно пропорционально его объёму. Чем выше давление, тем меньше объём, и наоборот.
Как объяснить это явление? Почему же при увеличении объёма газа его давление становится меньше?
Так как температура газа не меняется, то не меняется и частота ударов молекул о стенки сосуда. Если увеличивается объём, то концентрация молекул становится меньше. Следовательно, на единицу площади придётся меньшее количество молекул, которые соударяются со стенками в единицу времени. Давление падает. При уменьшении объёма число соударений, наоборот, возрастает. Соответственно растёт и давление.
Графически изотермический процесс отображают на плоскости кривой, которую называют изотермой. Она имеет форму гиперболы.
Каждому значению температуры соответствует своя изотерма. Чем выше температура, тем выше расположена соответсвующая ей изотерма.
Изобарный процесс
Процессы изменения температуры и объёма газа при постоянном давлении, называются изобарными. Для этого процесса m = const, P = const.
Зависимость объёма газа от его температуры при неизменяющемся давлении также была установлена экспериментальным путём французским химиком и физиком Жозефом Луи Гей-Люссаком, опубликовавшем его в 1802 г. Поэтому её называют законом Гей-Люссака «При постоянном давлении отношение объёма постоянной массы газа к его абсолютной температуре является постоянной величиной».
При Р = const уравнение объединённого газового закона превращается в уравнение Гей-Люссака.
Пример изобарного процесса — газ, находящийся внутри цилиндра, в котором перемещается поршень. При повышении температуры растёт частота ударов молекул о стенки. Увеличивается давление, и поршень приподнимается. В итоге увеличивается объём, занимаемый газом в цилиндре.
Графически изобарный процесс отображается прямой линией, которая называется изобарой.
Чем больше давление в газе, тем ниже расположена на графике соответствующая изобара.
Изохорный процесс
Изохорным, или изохорическим, называют процесс изменения давления и температуры идеального газа при постоянном объёме.
Для изохорного процесса m = const, V = const.
Представить такой процесс очень просто. Он происходит в сосуде фиксированного объёма. Например, в цилиндре, поршень в котором не двигается, а жёстко закреплён.
Изохорный процесс описывается законом Шарля: «Для данной массы газа при постоянном объёме его давление пропорционально температуре». Французский изобретатель и учёный Жак Александр Сезар Шарль установил эту зависимость с помощью экспериментов в 1787 г. В 1802 г. её уточнил Гей-Люссак. Поэтому этот закон иногда называют вторым законом Гей-Люссака.
При V = constиз уравнения объединённого газового закона получаем уравнение закона Шарля, или второго закона Гей-Люссака.
При постоянном объёме давление газа увеличивается, если увеличивается его температура.
На графиках изохорный процесс отображается линией, которая называется изохорой.
Чем больше объём занимаемый газом, тем ниже расположена изохора, соответствующая этому объёму.
В реальности ни один параметр газа невозможно поддерживать неизменным. Это возможно сделать лишь в лабораторных условиях.
Конечно, в природе идеального газа не существует. Но в реальных разреженных газах при очень низкой температуре и давлении не выше 200 атмосфер расстояние между молекулами намного превышает их размеры. Поэтому их свойства приближаются к свойствам идеального газа.
- < Назад
- Вперёд >
Общее определение
Идеальным газом названа модель, в которой взаимодействием между молекулами принято пренебрегать. Процесс взаимодействия частиц любого вещества друг с другом довольно сложный.
Когда они подлетают друг к другу вплотную и находятся на очень малом расстоянии, они сильно взаимоотталкиваются. Но на большой удаленности между молекулами действуют относительно небольшие силы притяжения. Если же среднее расстояние, на котором они находятся друг от друга, большое, это положение вещества называют разреженным газом. Взаимодействие таких частиц проявляется как редкие удары молекул. Это происходит, лишь когда они подлетают вплотную друг к другу. В идеальном же газе взаимодействие молекул не учитывается вообще. В идеальном газе количество молекул очень большое. Поэтому вычисления происходят только при помощи статистического метода. Причем следует отметить, что частички вещества в таком случае распределяются в пространстве равномерно. Это самое часто встречающееся состояние идеального газа.
Давление
Давление–это
силовое воздействие (F)
тела и его частей на окружающую среду
или оболочку и на соседние части того
же тела на единицу поверхности (S).
Это силовое воздействие направлено
перпендикулярно к любому элементу
поверхности и уравновешивается обратно
направленным силовым воздействием
окружающей среды, оболочки или соседнего
элемента того же тела.
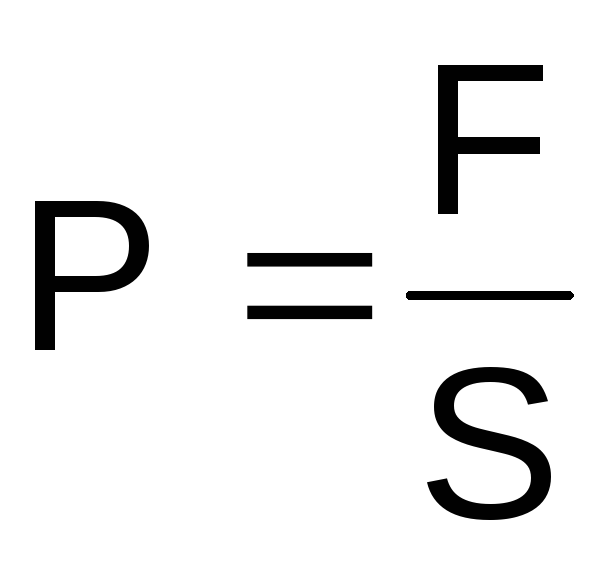 .
.
В
СИ используется единица давления паскаль
(Па), это 1 Н/м2,
т.е. сила в один ньютон, действующая по
нормали на площадь в один квадратный
метр. Для технических измерений паскаль
очень небольшая величина, поэтому ввели
кратную паскалю единицу давления бар:
1 бар = 105
Па. Выбор этой единицы измерения давления
объясняется тем, что атмосферное
давление воздуха над поверхностью Земли
приблизительно равно одному бару.
В
технике часто используется единица
давления в старой системе измерения
(СГС) – техническая
атмосфера:
1 атм = 1 кгс/см2
(не путать с понятием физической
атмосферы).
Часто
измеряют давление, особенно небольшое,
высотой столба жидкости (ртуть, вода,
спирт и т.д.). Столб жидкости (рис.1.5)
производит на основание сосуда давление,
определяемое равенством
Р
= F/S = HSρg/S
= ρgH,
(1.4)
где
ρ – плотность жидкости, кг/м3;
Н
– высота столба жидкости, м;
g
– ускорение свободного падения, м/с2;
F,
S – сила, действующая на дно сосуда, и
его площадь.
Из
уравнения (1.4) следует, что давлению Р
соответствует высота столба жидкости
Н = Р/(ρg), т.е. высота Н прямо пропорциональна
давлению, поскольку ρg – величина
постоянная.
В
практике высоту столба жидкости часто
берут для оценки давления. Поэтому метры
и миллиметры столба жидкости стали
единицами измерения давления. Для
перехода от высоты столба жидкости к
паскалям необходимо в формулу (1.4)
подставить все величины в СИ.
Например,
при 0оC
плотность воды составляет 1000 кг/м3,
ртути – 13595 кг/м3
в земных условиях. Подставив эти величины
в формулу (1.4), получим соотношения для
1мм столба этих жидкостей и давления в
паскалях:
Н
= 1 мм вод.ст. соответствует Р= 103·9,81·10-3=
9,81 Па;
Н
= 1 мм рт.ст. соответствует Р = 13595·9,81·10-3=
133,37 Па.
При
определении давления высотой столба
жидкости необходимо учитывать изменение
ее плотности в зависимости от температуры.
Это необходимо делать для сопоставления
результатов измерения давления. Так,
при определении атмосферного давления
с помощью ртутного барометра его
показания приводятся к 0 оС
исходя из соотношения
Во
= В (1 — 0,000172 t),
(1.5)
где
В – действительная высота ртутного
столба барометра при температуре ртути
t оС;
Во
– показания барометра, приведенные к
температуре 0 оС.
В
расчетах используются давления столбов
жидкости, приведенные к температуре 0
оС.
Измерение
давления
в технике основано на показаниях
различных приборов, действующих по
принципу отражения на шкале величины,
численно равной разности давлений в
месте замера и давления окружающей
среды. Как правило, приборы имеют
положительную шкалу, т.е. разность между
большим и меньшим давлением. Поэтому
они подразделяются на приборы для замерадавления:больше
атмосферного –манометры,
меньше атмосферного –вакуумметры.
П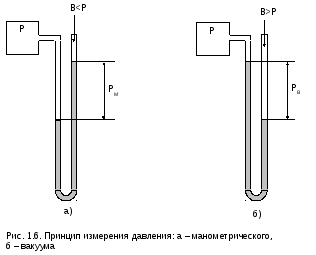 ример
ример
таких приборов в виде жидкостных
U-образных манометров (вакуумметров)
показан на рис. 1.6.
Давление
по шкале этих приборов называется
манометрическим давлением РМ
и вакуумом РВ
соответственно. Давление в месте замера
называется абсолютным Р, окружающей
среды – давлением атмосферного воздуха
или барометрическим В, поскольку прибор,
как правило, установлен в окружающем
его атмосферном воздухе.
Расчетные
зависимости давления по приборам будут
следующие:
манометрическое
давление:
РМ
= Р — В,
(1.6)
где
РМ
– манометрическое давление (по прибору);
Р
– абсолютное давление;
В
– давление атмосферного воздуха
(барометрическое давление);
вакуум:
РВ
= В — Р,
(1.7)
где
РВ
– вакуум (показания вакуумметра).
Параметром
состояния термодинамического тела
является абсолютное давление, при
использовании приборов оно будет
определяться в зависимости от типа
прибора по следующим зависимостям:
для
манометра
Р
= РМ
+ В,
(1.8)
для
вакуумметра
Р
= В — РВ
. (1.9)