Функции excel если (if) и еслимн (ifs) для нескольких условий
Содержание:
- Углекислый газ
- Химические свойства
- Химические формулы веществ немолекулярного строения
- «Альтернативное» применение и авторитетные мнения
- Метрологическое подтверждение оксидов азота
- Признаки употребления
- Фармакология
- Антропогенные источники выбросов диоксида азота
- Химические формулы веществ молекулярного строения
- Токсичность [ править ]
- Краткая характеристика оксида азота (IV):
- Применение диоксида углерода
- Что за соединения: CO, CO2, NOx?
- Измерение уровня загрязнения воздуха в лаборатории «НОРТЕСТ»
- Монооксид — азот
- Несолеобразующие соединения
- Химические свойства
- Литература[править | править код]
Углекислый газ
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Химические свойства
Кислотный оксид. NO2 отличается высокой химической активностью. Он взаимодействует с неметаллами (фосфор, сера и углерод горят в нём). В этих реакциях NO2 — окислитель:
Окисляет SO2 в SO3 — на этой реакции основан нитрозный метод получения серной кислоты:
При растворении оксида азота(IV) в воде образуются азотная и азотистая кислоты (реакция диспропорционирования):
Поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются HNO3 и NO:
Если растворение проводить в избытке кислорода, образуется только азотная кислота (NO2 проявляет свойства восстановителя):
При растворении NO2 в щелочах образуются как нитраты, так и нитриты:
Жидкий NO2 применяется для получения безводных нитратов:
В реакциях с галогенами образует соли нитрония, нитрозила и оксиды галогенов:
Химические формулы веществ немолекулярного строения
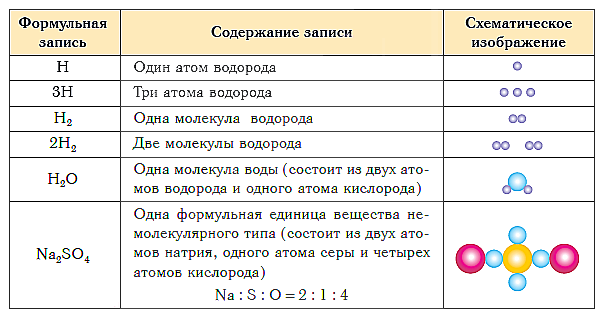
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
«Альтернативное» применение и авторитетные мнения
Воздушный шарик с закисью азота стоит несколько сотен рублей. Употребляют «веселящий газ» в основном молодые люди. Его продажа активно идет в Интернете, N 2 O торгуют даже оптом, литрами. Судя по сюжетам многочисленных видеороликов, опубликованных в Сети, подышавшие газом люди на время теряют рассудок, они начинают смеяться явно нездоровым смехом, многие бьются в истерике и падают без сознания.
Как утверждает врач-нарколог Амирьян Галиев, любая ошибка при дозировке вдыхаемой закиси азота может оказаться смертельной: дыхательная система человека блокируется и он теряет способность дышать. Галиев разъясняет, что закись азота повышает настроение, однако этот процесс на самом деле является предсмертным состоянием – из легких «выдавливается» кислород и мозг перестает им насыщаться в достаточном количестве. Психиатр-нарколог Константин Поплевченков подтверждает, что «веселящий газ» особенно опасен тем, что вдыхание даже небольшого количества закиси азота в чистом виде приводит к вытеснению из крови человека кислорода, вследствие чего возникает гипоксия головного мозга. Итог – кома или смерть. Коллега Поплавченкова врач-анестезиолог Анатолий Малышев дополняет, что закись азота наполняет кровь очень быстро, что может в «лучшем» случае сделать человека инвалидом, если, конечно, медики успеют откачать его.
Наркологи убеждены, что «веселящий газ», как и любое другое психоактивное вещество, вызывает привыкание (наркозависимость). Что, в свою очередь, выгодно продавцам закиси азота. Последствия использования «веселящего газа» в развлекательных целях уже неоднократно фиксировались в нашей стране. По сообщениям СМИ, в 2012 году в Тамбове трое молодых людей в возрасте до 30 лет после того, как надышались закисью азота, попали в психиатрическую клинику с галлюцинациями. В апреле прошлого года в Москве от закиси азота погибли студенты — девушка и парень. Когда вскрыли квартиру с двумя трупами, выяснилось, что баллон с газом был поврежден, погибла также собака, находившаяся в помещении.
Метрологическое подтверждение оксидов азота
Измерение выбросов
Методы хемилюминесценции можно использовать для измерения оксидов азота в выхлопных газах от стационарных источников . Для этого используется свойство монооксида азота излучать свет, когда он превращается в диоксид азота (хемилюминесценция). Типичный частичный поток отбирается из выхлопного газа и после прохождения через конвертер, который превращает любой диоксид азота, который может присутствовать в монооксид азота, приводится в контакт с озоном . Свет, излучаемый во время реакции, преобразуется фотоумножителем в электрический сигнал, который предоставляет информацию о концентрации оксида азота.
Для определения оксида азота и диоксида азота с помощью ионной хроматографии эти газы преобразуются в азотную кислоту с помощью озона или перекиси водорода и воды. Затем анализируется концентрация нитратов.
Другими методами измерения оксидов азота в выхлопных газах из стационарных источников являются метод салицилата натрия и метод диметилфенола. В процессе салицилата натрия оксид азота и диоксид азота окисляются до азотной кислоты, а затем превращаются в нитросалициловую кислоту с помощью салицилата натрия . Концентрация желтого аниона нитросалициловой кислоты, который образуется после следующей стадии обработки, может быть определена фотометрически и, таким образом, предоставлена информация о концентрации оксида азота в отобранном газе. Для диметилфенольного процесса монооксид азота и диоксид азота окисляются до пятиокиси азота с помощью озона в газовой фазе, который после абсорбции водой превращается с 2,6-диметилфенолом в растворах серной и фосфорной кислоты в 4-нитро-2, 6-диметилфенол , анион которого также может быть измерен фотометрически.
Одним из методов определения закиси азота в выхлопных газах от стационарных источников является недисперсионный инфракрасный метод . Для этого газ в измерительной газовой ячейке и эталонной ячейке освещается инфракрасным излучателем. Оба луча обнаруживаются приемником и сравниваются друг с другом. Ослабленный луч по сравнению с эталонной ячейкой является мерой концентрации закиси азота. Чтобы свести к минимуму перекрестную чувствительность процесса из-за мешающего монооксида углерода , он превращается в диоксид углерода с помощью преобразователя из оксидов металлов .
Важно, чтобы все компоненты измерительного устройства, которые вступают в контакт с отбираемым газом, не вступали в реакцию с оксидами азота
Измерение иммиссии
Измерение на оживленной дороге как индикатор качества воздуха
Зольцман метод может быть использован для измерения в иммиссия диоксида азота , в котором образец воздух пропускают через реакционный раствор , который вступает в реакцию с компонентом газа , чтобы быть обнаруженным , чтобы сформировать красный азокраситель . Интенсивность окраски реакционного раствора определяется фотометрически и является мерой массы диоксида азота. Используя окислитель, можно также использовать метод Зальцмана для определения оксида азота.
Как и в случае измерения эмиссии , хемилюминесцентные методы также могут использоваться для измерения иммиссии.
Другой возможностью для измерения содержания диоксида азота является использование пассивных коллекторов . Проволочная сетка, изготовленная из триэтаноламина, на которую нанесен диоксид азота, расположена в стеклянной трубке, открытой снизу . По окончании периода сбора проволочная сетка обрабатывается комбинированным реагентом для фотометрического анализа результирующего изменения цвета.
Признаки употребления
Первыми признаками могут оказаться ссадины на теле и синяки. Если человек вдохнет большое количество закиси, полностью погрузившись в наркоз, устоять ему на месте просто не удастся, он непременно упадет на землю и травмирует себя.
Баротравмы легких, обморожение ротовой полости, поскольку некоторые вдыхают его из баллончика, где давление газовой смеси составляет 40 атмосфер, что и приводит к таким последствиям. Вдыхание закиси азота на первых секундах не дает никакого эффекта, потом, спустя секунд 30 у человека происходит дефицит кислорода в головном мозге и он теряет сознание, в состоянии опьянения алкоголем, это особенно опасно. При передозировке веселящим газом, может сформироваться асфиксия – кислородное голодание и за этим последовать смерть.
Наркотическое опьянение веселящим газом длится примерно 30 минут, при повторном вдыхании оно может длится до нескольких часов. По силе напоминает алкогольное включающее в себя:
- существенное улучшение настроения;
- легкое головокружение и шум;
- приятную волну тепла по телу;
- расслабленность, смех, веселье;
- беспечность.
Именно в эти моменты у человека происходят галлюциногенные проявления и преимущественно приятные. Краски вокруг становятся яркими, звуки – четкими, прилив сил – зашкаливает.
Фармакология
Добавочный оксид азота
NO, который синтезируется в организме и впоследствии высвобождается в кровь, имеет период полувыведения в 5 секунд или меньше, при этом в лабораторных условиях могут создаваться некоторые комплексы для увеличения периода полувыведения до 445 с или около того в целях исследования. Эти короткие периоды полувыведения свидетельствуют о быстром распаде молекулы оксида азота на составляющие (азот и кислород), при этом надлежащее хранение NO может увеличивать срок хранения, как было подтверждено, только до 5 дней, при использовании майларовых баллонов, которые замедляют разрушение. В связи с низкой устойчивостью вне организма, оксид азота по существу никогда не используется в качестве добавки, скорее используются соединения, которые могут сохраняться в крови на протяжении времени, достаточного для непрерывной выработки нового NO.
Оксид азота по существу неустойчив и имеет короткий период полувыведения; он оказывает полезное действие немедленно, но не имеет значения в качестве добавки и сам по себе. Добавка NO требует других соединений, которые оказывают влияние на внутреннюю систему выработки оксида азота.
Антропогенные источники выбросов диоксида азота
Более 90% от общего количества выбросов оксидов азота попадают в воздушную среду при сжигании различных видов топлива. Начальной формой является NO, который, находясь в воздухе, окисляется кислородом при высокой температуре до NO2.

Основные источники, влияющие на выброс диоксида азота в атмосферу:
- автотранспортные средства, выхлопные газы которых вносят наибольший вклад в концентрацию вещества в городском воздухе;
- теплоэлектростанции;
- промышленные предприятия, в частности, нефтепромышленной и металлургической отрасли, а также заводы, производящие азотную кислоту и различные удобрения;
- сжигание твердых отходов (в частности, на мусоросжигательных заводах).

Бурый оттенок газа позволяет наблюдать его визуально в воздухе больших городов, где суточная динамика концентраций оксидов азота довольно тесно связана с интенсивностью движения автотранспортных средств и солнечного излучения. В утренние часы увеличение количества автомобилей на дорогах приводит к заметному повышению содержания монооксида азота, который с восходом солнца в результате фотохимического окисления переходит в NO2. Также бурый цвет имеют выбросы некоторых химических предприятий, из-за чего их называют «лисьими хвостами». Особенно заметны они летом.

Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Токсичность [ править ]
Газообразный NO2диффундирует в жидкость эпителиальной выстилки (ELF) респираторного эпителия, растворяется и химически реагирует с антиоксидантными и липидными молекулами в ELF; воздействие на здоровье NO2вызваны продуктами реакции или их метаболитами, которые представляют собой активные формы азота и активные формы кислорода, которые могут вызывать бронхоспазм , воспаление, снижение иммунного ответа и могут оказывать влияние на сердце.
Пути, обозначенные пунктирной линией, представляют собой те пути, свидетельства которых ограничены результатами экспериментальных исследований на животных, в то время как данные исследований контролируемого воздействия на человека доступны для путей, указанных сплошной линией. Пунктирными линиями обозначены предполагаемые связи с исходами обострения астмы и инфекций дыхательных путей. Ключевые события — это субклинические эффекты, конечные точки — это эффекты, которые обычно измеряются в клинике, а исходы — это последствия для здоровья на уровне организма. NO 2 = диоксид азота; ELF = эпителиальная слизистая жидкость. : 4–62
Трубка диффузии диоксида азота для контроля качества воздуха. Расположен в лондонском Сити
Острый вред из-за НЕТ2воздействие может возникнуть только в производственных условиях. Прямое попадание на кожу может вызвать раздражение и ожоги. Только очень высокие концентрации газообразной формы вызывают немедленное расстройство: 100–200 частей на миллион могут вызвать легкое раздражение носа и горла, 250–500 частей на миллион могут вызвать отек , приводящий к бронхиту или пневмонии , а уровни выше 1000 частей на миллион могут вызвать смерть из-за удушье из-за жидкости в легких. Во время воздействия часто нет никаких симптомов, кроме преходящего кашля, усталости или тошноты, но через несколько часов воспаление в легких вызывает отек.
При попадании на кожу или в глаза пораженный участок промывают физиологическим раствором. Для ингаляции вводится кислород, могут вводиться бронходилататоры , а при появлении признаков метгемоглобинемии — состояния, которое возникает, когда соединения на основе азота влияют на гемоглобин в красных кровяных тельцах, может вводиться метиленовый синий .
Он классифицируется как чрезвычайно опасное вещество в Соединенных Штатах, как определено в разделе 302 Закона США о чрезвычайном планировании и праве на информацию (42 USC 11002), и в отношении него применяются строгие требования к отчетности со стороны предприятий, которые производят, хранят , или использовать его в значительных количествах.
Краткая характеристика оксида азота (IV):
Оксид азота (IV) – неорганическое вещество, ядовитый газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Оксид азота (IV) содержит один атом азота и два атома кислорода.
Химическая формула оксида азота (IV) NO2.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C оксид азота (IV) состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
В точке кипения NO2 – +21,1 °C представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже +21°С – это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Кислотный оксид.
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
Применение диоксида углерода
Пищевая промышленность после масштабного получения «сухого льда» перешла на принципиально новый метод хранения продуктов. Он незаменим при производстве газированных напитков и минеральной воды. Содержание СО2 в напитках придает им свежесть и заметно увеличивает срок хранения. А карбидизация минеральных вод позволяет избежать затхлости и неприятного вкуса.

В кулинарии часто используют метод погашения лимонной кислоты уксусом. Выделяющийся при этом углекислый газ придает пышность и легкость кондитерским изделиям.
Данное соединение часто используется в качестве пищевой добавки, повышающей срок хранения пищевых продуктах. Согласно международным нормам классификации химических добавок содержания в продуктах, проходит под кодом Е 290,
Порошкообразный углекислый газ – одно из наиболее популярных веществ, входящих в состав пожаротушительных смесей. Это вещество встречается и в пене огнетушителей.
Транспортировать и хранить углекислый газ лучше всего в металлических баллонах. При температуре более 31⁰С давление в баллоне может достигнуть критического и жидкий СО2 перейдет в сверхкритическое состояние с резким подъемом рабочего давления до 7,35 МПа. Металлический баллон выдерживает внутреннее давление до 22 МПа, поэтому диапазон давления при температурах свыше тридцати градусов признается безопасным.
Что за соединения: CO, CO2, NOx?
Я даже почти разобралась с двумя первыми, вроде как окись углерода и двуокись углерода — но точное ли это название? В третьем скорее всего вместо х могут стоять разные циферки, но название будет общее?
Помогите, надо очень-очень срочно.
СО — оксид углерода(II), окись углерода (устаревшее название), угарный газ (бытовое название).
СО2 — оксид углерода(IV), диоксид углерода, двуокись углерода, угольный ангидрид, ангидрид угольной кислоты, углекислый газ.
NOx — общее название оксидов азота в химии атмосферы, включая выбросы двигателей внутреннего сгорания, разных топок — везде, где при высокой температуре реагируют кислород и азот воздуха. Это только два газа NO и NO2 (остальные оксиды азота не образуются). NO на воздухе окисляется до NO2. Оксиды азота и сами вредны, и способствуют образованию смога, и в атмосфере могут давать пероксиацетилнитрат (ПАН), вызывающий паралич сердца. К счастью, высокие его концентрации исключительно редки.
Если элемент имеет несколько валентностей, или он может иметь различную степень окисления, то возможно образование нескольких соединений с кислородом.
1.Углерод может иметь степень окисления в соединениях с кислородом (2+, 4+) или валентность II и IV, поэтому существует
- окись углерода СО, или оксид углерода (II);
- двуокись углерода СО2, или оксид углерода (IV).
2.Азот может иметь валентность или степень окисления в соединениях с кислородом: 1+, 2+, 3+, 4+, 5+ всегда с плюсом ( отдает электроны), поэтому он может иметь несколько оксидов:
- N20 — закись азота, или оксид азота (I);
- NO — окись азота, или оксид азота (II),
- N2O3 — окись азота, или оксид азота (III),
- NO2 — двуокись азота, или оксид азота (IV),
- N2O5 — пятиокись азота, или оксид азота (V).
Порой в химии некоторые соединения вызывают серьёзные затруднения, поскольку одна и та же химическая формула может иметь несколько названий.
Ниже предлагаю ознакомиться с тремя формулами CO, CO2, NOx, а также с их кратким описанием.



СО — окись или оксид углерода, соединение СО2 — углекислый газ, NO — нитрат, NO2 — нитрит, а вот у нитридов не помну сколько молекул кислорода.
Окись углерода, химическая формула — СО, это бесцветный газ без запаха и вкуса, но очень токсичный. Он является продуктом неполного сгорания углеродсодержащих соединений.
Диоксиид углероода или двуоокись углерода СО2 — присутствует в атмосфере в количестве примерно 385 частей на миллион (по объему) или 0,039%. 50 лет назад эта пропорция была гораздо меньше и составляла 280 частей на миллион.
NOx — оксиды азота, это семейство ядовитых, химически активных газов, которые образуются при сгорании топлива. NOx — побочный продукт работы почти всех транспортных средств (автомобили, строительная техника, лодки), а также промышленных предприятий: электростанций, различных печей, турбин и т.п. NOx является сильным окислителем, вступает в контакт с летучими органическими соединениями.
Измерение уровня загрязнения воздуха в лаборатории «НОРТЕСТ»
С целью принятия оперативных мер по очистке воздуха от загрязнений, в том числе связанных с диоксидом азота, может потребоваться проведение соответствующих анализов. Испытательный центр «НОРТЕСТ» готов выполнить необходимые независимые исследования, гарантируя достоверные результаты и действуя в соответствии с установленными стандартами.
Наша лаборатория оснащена необходимым оборудованием для проведения анализов разной сложности. Также наши специалисты могут выехать на объект для забора проб и их безопасной доставки в центр. В случае определения повышенной концентрации диоксида азота, мы поможем в разработке решений, направленных на очистку воздуха от вредных примесей. Для этого может использоваться несколько способов, включая окисление, а также сорбционные методики.
Полезные статьи
Агрохимический анализ и исследования почв
Хлорорганические пестициды в воде
Методы определения бенз(а)пирена в почвах и грунтах
Монооксид — азот
Монооксид азота выполняет в организме роль нейромедиато-ра, развивает иммунные реакции и участвует в системе долговременной памяти. За это открытие ученым была, присуждена Нобелевская премия в области медицины за 1998 г. В настоящее время ведутся интенсивные работы по синтезу и поиску новейших лекарственных веществ, генерирующих NO в организме.
Монооксид азота поступает в атмосферу в результате процессов сгорания, протекающих в природе, и в виде продукта жизнедеятельности бактерий. Общее количество оксидов азота из природных источников в мировом масштабе оценивается в 450 млн. т / год.
Монооксид азота оказывает вредное действие на гемоглобин крови, который превращается в нитрогемоглобин. Степень воздействия NOx на организм человека приблизительно в 10 раз сильнее воздействия СО.
Монооксид азота применяется для получения азотной кислоты.
Монооксид азота термодинамически неустойчив.
Монооксид азота проявляет и окислительные, и восстановительные свойства.
Монооксид азота может быть лигандом в комплексных соединениях. При составлении названий комплексных соединений, в которых NO выступает в качестве лиганда его называют нитрозил. Например, SO4 — сульфат нит-розилпентаакважелеза ( П), — тетранитрозилжелезо, Na2 — пентацианонитрозилферрат ( Ш) натрия.
|
Некоторые свойства оксидов азота. |
Монооксид азота, имеющий неподеленные пары электронов, может быть лигандом. В последние годы обнаружено, что NO синтезируется в организме человека ( до 100 мг в сутки) и играет важную роль в регуляции кровяного давления, секреции инсулина, почечной фильтрации, в функционировании механизмов памяти и других процессах.
Монооксид азота NO — бесцветный, малорастворимый в воде газ. Он токсичен, связывает гемоглобин крови.
Получают монооксид азота действием азотной кислоты ( разб.
Кипит жидкий монооксид азота при — 151 8 С.
| Строение |
Молекула монооксида азота легко ионизируется с образованием катиона нитрозила NO, изоэлектронного с молекулой монооксида углерода.
На образование монооксида азота NO затрачивается большое количество энергии, идущей на разрыв связей в молекулах исходных веществ. Энергия связи в молекуле NO составляет 627 кДж / моль; это значительно меньше, чем в молекуле азота. Поэтому образование NO происходит при очень высокой температуре — выше 1500 С. В промышленности азот получают из воздуха. Для этого воздух сжижают при высоком давлении и низкой температуре, а затем подвергают фракционированной перегонке.
Несолеобразующие соединения
Второй класс соединений — несолеобразующие. В неё входят оксид одновалентного и двухвалентного азота. Вещество с формулой N2O имеет линейное строение молекулы. Представляет собой газ, не имеющий цвета. В нормальных условиях вещество инертно. Обладает сладковатым вкусом и слабым запахом. Легко растворяется в воде, однако не вступает с ней в химические реакции. С водородом реагирует со взрывом. Не вступает в химические реакции с кислотами и основаниями.
Вступая в контакт с окислителями, N2O выступает в роли восстановителя. К примеру, раствор перманганата в серной кислоте окисляет закись азота до образования монооксида. В водном растворе окисляет диоксид серы до серной кислоты.
Монооксид (II) — NO. При низких температурах молекулы димеризуются и образуют новое вещество. Окись азота представляет собой газ без цвета и запаха, малорастворимый в воде. В присутствии кислорода загорается, образуется диоксид — вещество коричневого цвета. Под действием хлора или озона легко окисляется. Жидкая и твёрдая форма имеет голубую окраску. Вступает во взаимодействие с основаниями и основными оксидами.
Химические свойства
При взаимодействии с сильными окислителями 4-диоксид углерода проявляет окислительные свойства. Типичная реакция этого взаимодействия:
Так, при помощи угля диоксид углерода восстанавливается до своей двухвалентной модификации — угарного газа.
При нормальных условиях углекислый газ инертен. Но некоторые активные металлы могут в нем гореть, извлекая из соединения кислород и высвобождая газообразный углерод. Типичная реакция – горение магния:
2Mg + CO2 = 2MgO + C.
В процессе реакции образуется оксид магния и свободный углерод.

В химических соединениях СО2 часто проявляет свойства типичного кислотного оксида. Например, он реагирует с основаниями и основными оксидами. Результатом реакции становятся соли угольной кислоты.
Например, реакция соединения оксида натрия с углекислым газом может быть представлена так:
Литература[править | править код]
Оксиды
| H2O | ||||||||||||||||
| Li2OLiCoO2Li3PaO4Li5PuO6Ba2LiNpO6LiAlO2Li3NpO4Li2NpO4Li5NpO6LiNbO3 | BeO | B2O3 | С3О2C12O9COC12O12C4O6CO2 | N2ONON2O3N4O6NO2N2O4N2O5 | O | F | ||||||||||
| Na2ONaPaO3NaAlO2Na2PtO3 | MgO | AlOAl2O3NaAlO2LiAlO2AlO(OH) | SiOSiO2 | P4OP4O2P2O3P4O8P2O5 | S2OSOSO2SO3 | Cl2OClO2Cl2O6Cl2O7 | ||||||||||
| K2OK2PtO3KPaO3 | CaOCa3OSiO4CaTiO3 | Sc2O3 | TiOTi2O3TiO2TiOSO4CaTiO3BaTiO3 | VOV2O3V3O5VO2V2O5 | FeCr2O4CrOCr2O3CrO2CrO3MgCr2O4 | MnOMn3O4Mn2O3MnO(OH)Mn5O8MnO2MnO3Mn2O7 | FeCr2O4FeOFe3O4Fe2O3 | CoFe2O4CoOCo3O4CoO(OH)Co2O3CoO2 | NiONiFe2O4Ni3O4NiO(OH)Ni2O3 | Cu2OCuOCuFe2O4Cu2O3CuO2 | ZnO | Ga2OGa2O3 | GeOGeO2 | As2O3As2O4As2O5 | SeOCl2SeOBr2SeO2Se2O5SeO3 | Br2OBr2O3BrO2 |
| Rb2ORbPaO3Rb4O6 | SrO | Y2O3YOFYOCl | ZrO(OH)2ZrO2ZrOSZr2О3Сl2 | NbONb2O3NbO2Nb2O5Nb2O3(SO4)2LiNbO3 | Mo2O3Mo4O11MoO2Mo2O5MoO3 | TcO2Tc2O7 | Ru2O3RuO2Ru2O5RuO4 | RhORh2O3RhO2 | PdOPd2O3PdO2 | Ag2OAg2O2 | Cd2OCdO | In2OInOIn2O3 | SnOSnO2 | Sb2O3Sb2O4Hg2Sb2O7Sb2O5 | TeO2TeO3 | I2O4I4O9I2O5 |
| Cs2OCs2ReCl5O | BaOBaPaO3BaTiO3BaPtO3 | HfO(OH)2HfO2 | Ta2OTaOTaO2Ta2O5 | WO2Br2WO2WO2Cl2WOBr4WOF4WOCl4WO3 | Re2OReORe2O3ReO2Re2O5ReO3Re2O7 | OsOOs2O3OsO2OsO4 | Ir2O3IrO2 | PtOPt3O4Pt2O3PtO2K2PtO3Na2PtO3PtO3 | Au2OAuOAu2O3 | Hg2OHgO(Hg3O2)SO4Hg2O(CN)2Hg2Sb2O7Hg3O2Cl2Hg5O4Cl2 | Tl2OTl2O3 | Pb2OPbOPb3O4Pb2O3PbO2 | BiOBi2O3Bi2O4Bi2O5 | PoOPoO2PoO3 | At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2SLa2O3 | Ce2O3CeO2 | PrOPr2O2SPr2O3Pr6O11PrO2 | NdONd2O2SNd2O3NdHO | Pm2O3 | SmOSm2O3 | EuOEu3O4Eu2O3EuO(OH)Eu2O2S | Gd2O3 | Tb | Dy2O3 | Ho2O3Ho2O2S | Er2O3 | Tm2O3 | YbOYb2O3 | Lu2O2SLu2O3LuO(OH) | ||
| Ac2O3 | UO2UO3U3O8 | PaOPaO2Pa2O5PaOS | ThO2 | NpONpO2Np2O5Np3O8NpO3 | PuOPu2O3PuO2PuO3PuO2F2 | AmO2 | Cm2O3CmO2 | Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |