Уроки по неорганической химии для подготовки к егэ
Содержание:
- Как работает закись азота
- Описание одновалентного оксида азота
- Строение молекулы и физические свойства
- Образование и характеристики
- Литература
- Что такое Закись Азота
- Методики исследований
- Влияние NO на здоровье2 экспозиция
- Клиническая информация, средства защиты, первоочередные действия в очаге
- Физические свойства оксида азота (IV):
- Литература[править | править код]
- Взаимодействие оксидов со средними солями
- Химические свойства
- Что мы узнали?
- Тест по теме
- Получение в природе и промышленности
- Химические свойства[править | править код]
- Нитриты и нитраты
- Формулы оксидов азота
Как работает закись азота

«Форсаж» познакомил большую часть населения с закисью азота. Как же она работает?
«Форсаж» – это один из самых дурацких автомобильных фильмов. За его сюжетом настолько легко следить, что даже не обязательно при этом знать английский язык. Но именно «Форсаж» познакомил большую часть населения с закисью азота. Возникает логичный вопрос: как же она работает?
Рецепт для любой реакции горения включает в себя топливо и кислород (его ваш двигатель получает из воздуха). Однако в воздухе кислорода не так и много (78% – это азот), то есть приличная часть всасываемой смеси теряется впустую. И вот тут на помощь приходит нитро!

В ДВС комбинация топлива и воздуха поджигается либо с помощью искры (в бензиновых моторах), либо с помощью сжатия (в дизельных моторах). Расширяющийся газ толкает поршень вниз (рабочий ход), передавая движение на коленвал, который в свою очередь через целый набор муфт, шестеренок, ремней и других валов направляет энергию на колеса.
Закись азота или N2O состоит из двух атомов азота и одного атома кислорода. При температуре около 300 градусов Цельсия химическая связь в молекуле разрушается, и кислород высвобождается. Таким образом в камере сгорания кислорода становится больше, что позволяет впрыскивать больше топлива, чтобы сохранить соотношение воздух/топливо оптимальным. Все это конвертируется в увеличенный крутящий момент и более быстрое ускорение.
В какой-то степени система во многом похожа на турбину, то есть ее задача загнать как можно больше кислорода в цилиндр. Только в отличие от турбины система закиси азота изменяет химический состав смеси.
Но если для сгорания необходим именно кислород, то зачем применять какой-то другой газ? Ну, закись азота предпочтительнее обычного сжатого кислорода, потому что она хорошо «упаковывается». Закись может быть легко сжижена, если находится под давлением, в то время как сжижение кислорода требует его замораживания до каких-то невероятных температур. N2O в плотном жидком состоянии занимает меньше места и содержит больше кислорода на единицу объема, чем сжатый газообразный O2. Плюс ко всему он безопаснее.
Автомобильная закись содержится в баллоне под давлением. Когда она подается в мотор, она представляет собой очень холодный газ, который охлаждает систему впуска, увеличивает плотность и дает еще больше кислорода. Количество этого газа контролируется жиклерами. От них зависит и уровень дополнительной мощности.

Система закиси азота полагается на существующий воздушный поток в двигатель. Поэтому нужно быть на полном газу, чтобы ее использовать. Если у вас механика, не вздумайте активировать нитро, когда убираете ногу с педали газа, чтобы переключить передачу, иначе может произойти обратный удар.
Система закиси азота – относительно недорогой способ быстрого добавления мощности. Комплект можно приобрести дешевле 1000 долларов. Наибольший смысл закись азота имеет, если вы участвуете в дрэг-рэйсинге.
Сам комплект имеет много составляющих и не работает по принципу «подключил и поехал». Он состоит из баллона, магистралей, соленоидов, жиклеров и проводки. Баллон обычно располагается в багажнике, а магистрали из нержавейки вплетаются в моторный отсек. Они соединены с соленоидами, которые функционируют как электрические клапаны, запуская или прерывая поток. Соленоиды спарены с жиклерами на впускном коллекторе, которые непосредственно впрыскивают закись азота в мотор.

Не думайте, что после монтажа системы все будет работать безупречно. Для начала нужно внести изменения в фазы зажигания. К счастью, некоторые комплекты поставляются с программным обеспечением, которое может это все отрегулировать.

Каждый мотор реагирует на дополнительную мощность по-разному. Прежде чем устанавливать систему закиси азота, нужно убедиться, что «железо» (двигатель, трансмиссия и система охлаждения) способно ее переварить.
Каждый, кто хоть раз смотрел известный во всем мире «Форсаж», наверняка заметил, что парни-гонщики и их красавицы-спутницы ездят на далеко не серийных автомобилях. Немудрено, что после выхода картины многие любители скорости и острых ощущений начали задумываться и от тюнинге своего авто. Для кото-то все закончилось наклейкой ярких стикеров, кто-то пошел чуть дальше и преобразил салон автомобиля, а самые отчаянные решили не ограничиваться полумерами и замахнулись на установку закиси азота. Еще бы… Ведь забыть, как «выстреливает» автомобиль после одного лишь нажатия кнопки, решительно невозможно. Но это в фильме. Будет ли такой сногсшибательный эффект в реальной жизни – вопрос пока открытый. Так что перед установкой закиси азота в любом случае не помешает разобраться с тем, что это такое и как оно работает.

Описание одновалентного оксида азота
Он еще именуется диазотом, закисью и газом веселящим. Последнее название произошло от действия, связанного с опьянением.
Оксид азота с валентностью I в условиях нормальной температуры существует в форме негорючего газа, без цвета, который проявляет приятный сладковатый привкус и запах. Воздух легче данного соединения. Оксид растворяется в водной среде, этаноле, эфирах и кислоте серной.
Вода, щелочные и кислотные растворы не способны с ним вступать в реакцию, он не образует соли. Не подвергается воспламенению, зато способен поддержать процесс горения.
Аммиак оксид азота переводит в азид (N3NH4).
При соединении с молекулами эфиров, хлорэтана и циклопропана образуется взрывоопасная смесь.
Обычные условия способствуют его инертности. Под действием нагревания вещество восстанавливается.
Строение молекулы и физические свойства
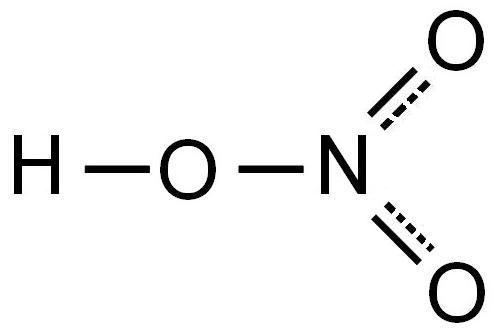
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:
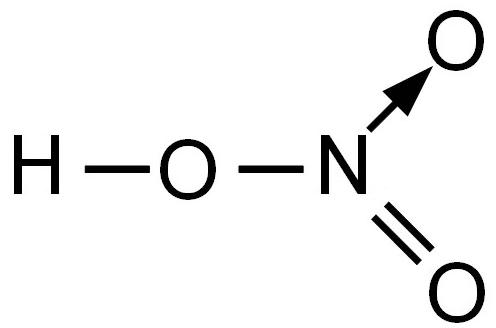
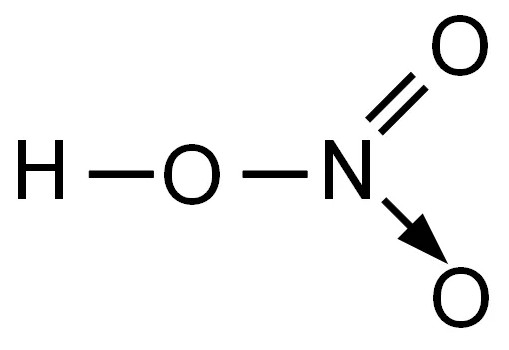
Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:
Образование и характеристики
Оксиды азота образуются из элементов без исключения в результате эндотермических реакций, то есть они образуются только из элементов, находящихся под внешним давлением (подача энергии). С другой стороны, это означает, что они могут использоваться в промышленности в качестве окислителя, например, тетроксид диазота в ракетной технике или веселящий газ (оксид диазота, N 2 O) для горячего пламени . За исключением веселящего газа, они действуют как генераторы кислоты по отношению к воде (например, в атмосфере ). Из-за образования кислоты (на слизистых оболочках), помимо прочего, они вызывают раздражение и токсичность
Тем самым они (за исключением веселящего газа) на ранней стадии привлекли внимание окружающей среды. С одной стороны, закись азота имеет медицинское и техническое применение, с другой стороны, она непреднамеренно выбрасывается в атмосферу во время технических и сельскохозяйственных процессов.
Триоксид диазота имеет темно-синий цвет в конденсированной форме (−21 ° C) и бледно-голубой цвет в твердой форме (−102 ° C). При температуре выше 0 ° C соединение распадается на монооксид азота и диоксид азота.
Формально тринитрамид (N (NO 2 ) 3 или N 4 O 6 ), нитрилазид (O 2 N — N 3 или N 4 O 2 ) и нитрозилазид (ON — N 3 или N 4 O) также могут быть отнесены к оксиды азота становятся. Связь крайне нестабильна. До сих пор тринитрамид и нитрилазид можно было получить и обнаружить только в растворе. Нитрозилазид существует при температуре ниже -50 ° C в виде бледно-желтого твердого вещества. Кроме того, существует нитратный радикал (NO 3 , бесцветный), который стабилен только при температуре ниже -142 ° C и который также встречается в форме изомерного пероксида, а также димер закиси азота (N 2 O 6 , O 2 N- OO-NO 2 ), который также является одной из пероксидов.
| Степень окисления N | Молекулярная формула | описание |
|---|---|---|
| +0,5 | N 4 O | Нитрозилазид |
| +1 | N 2 O | Закись азота (веселящий газ) |
| +1 | N 4 O 2 | Нитрил азид |
| +2 | НЕТ | Оксид азота |
| +3 | N 2 O 3 | Оксид азота |
| +3 | N 4 O 6 | Тринитрамид |
| +4 | НЕТ 2 | Диоксид азота |
| +4 | N 2 O 4 | Четырехокись азота |
| +5 | N 2 O 5 | Оксид азота |
Азотные газы образуются, среди прочего, при реакции азотной кислоты (HNO 3 ) с органическими веществами или металлами. При реакции азотной кислоты с серебром и медью образуется большое количество NO x . Типичный красно-коричневый цвет азотистых газов в основном обусловлен диоксидом азота (NO 2 ). Азотные газы имеют характерный резкий запах и могут вызывать отек легких с задержкой более 24 часов ( латентный период ) после вдыхания .
Литература
Оксиды
| H2O | ||||||||||||||||
| Li2OLiCoO2Li3PaO4Li5PuO6Ba2LiNpO6LiAlO2Li3NpO4Li2NpO4Li5NpO6LiNbO3 | BeO | B2O3 | С3О2C12O9COC12O12C4O6CO2 | N2ONON2O3N4O6NO2N2O4N2O5 | O | F | ||||||||||
| Na2ONaPaO3NaAlO2Na2PtO3 | MgO | AlOAl2O3NaAlO2LiAlO2AlO(OH) | SiOSiO2 | P4OP4O2P2O3P4O8P2O5 | S2OSOSO2SO3 | Cl2OClO2Cl2O6Cl2O7 | ||||||||||
| K2OK2PtO3KPaO3 | CaOCa3OSiO4CaTiO3 | Sc2O3 | TiOTi2O3TiO2TiOSO4CaTiO3BaTiO3 | VOV2O3V3O5VO2V2O5 | FeCr2O4CrOCr2O3CrO2CrO3MgCr2O4 | MnOMn3O4Mn2O3MnO(OH)Mn5O8MnO2MnO3Mn2O7 | FeCr2O4FeOFe3O4Fe2O3 | CoFe2O4CoOCo3O4CoO(OH)Co2O3CoO2 | NiONiFe2O4Ni3O4NiO(OH)Ni2O3 | Cu2OCuOCuFe2O4Cu2O3CuO2 | ZnO | Ga2OGa2O3 | GeOGeO2 | As2O3As2O4As2O5 | SeOCl2SeOBr2SeO2Se2O5SeO3 | Br2OBr2O3BrO2 |
| Rb2ORbPaO3Rb4O6 | SrO | Y2O3YOFYOCl | ZrO(OH)2ZrO2ZrOSZr2О3Сl2 | NbONb2O3NbO2Nb2O5Nb2O3(SO4)2LiNbO3 | Mo2O3Mo4O11MoO2Mo2O5MoO3 | TcO2Tc2O7 | Ru2O3RuO2Ru2O5RuO4 | RhORh2O3RhO2 | PdOPd2O3PdO2 | Ag2OAg2O2 | Cd2OCdO | In2OInOIn2O3 | SnOSnO2 | Sb2O3Sb2O4Hg2Sb2O7Sb2O5 | TeO2TeO3 | I2O4I4O9I2O5 |
| Cs2OCs2ReCl5O | BaOBaPaO3BaTiO3BaPtO3 | HfO(OH)2HfO2 | Ta2OTaOTaO2Ta2O5 | WO2Br2WO2WO2Cl2WOBr4WOF4WOCl4WO3 | Re2OReORe2O3ReO2Re2O5ReO3Re2O7 | OsOOs2O3OsO2OsO4 | Ir2O3IrO2 | PtOPt3O4Pt2O3PtO2K2PtO3Na2PtO3PtO3 | Au2OAuOAu2O3 | Hg2OHgO(Hg3O2)SO4Hg2O(CN)2Hg2Sb2O7Hg3O2Cl2Hg5O4Cl2 | Tl2OTl2O3 | Pb2OPbOPb3O4Pb2O3PbO2 | BiOBi2O3Bi2O4Bi2O5 | PoOPoO2PoO3 | At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2SLa2O3 | Ce2O3CeO2 | PrOPr2O2SPr2O3Pr6O11PrO2 | NdONd2O2SNd2O3NdHO | Pm2O3 | SmOSm2O3 | EuOEu3O4Eu2O3EuO(OH)Eu2O2S | Gd2O3 | Tb | Dy2O3 | Ho2O3Ho2O2S | Er2O3 | Tm2O3 | YbOYb2O3 | Lu2O2SLu2O3LuO(OH) | ||
| Ac2O3 | UO2UO3U3O8 | PaOPaO2Pa2O5PaOS | ThO2 | NpONpO2Np2O5Np3O8NpO3 | PuOPu2O3PuO2PuO3PuO2F2 | AmO2 | Cm2O3CmO2 | Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Что такое Закись Азота
Что такое? Оксид азота — бесцветный газ с характерным запахом, тяжелее воздуха (относительная плотность 1,527). Оксид азота применяется в медицине для наркоза. Химическая формула — N2О Содержание основного вещества( N2О) — не менее 97% Мощность производства — до 5,4 тыс. тонн в год Качество медицинской оксида азота соответствует требованиям Фармакопейной статьи ФС 42-2926-92. Свойства: При температуре 0 оС и давлении 40 ати закись азота сгущает-ся в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Не воспламеняется, но поддерживает горение. Закись азота при вдыхании не вызывает раздражения дыхательных путей, с гемоглобином не связывается. После прекращения вдыхания через 10-15 минут полностью выделяется через дыхательные пути. Применяется в смеси с кислородом в качестве наркоза в хирурги-ческой практике, оперативной гинекологии, хирургической стоматологии, для обезболивания родов, для профилактики травматического шока в послеоперационный период, а также для купирования болевых приступов при острой коронарной недостаточности, инфаркте миокарда, остром панкреатите и других патало-гических состояниях, сопровождающихся болями. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ Смеси с эфиром, циклопропаном , хлорэтилом в определенных концентрациях взрывоопасны. УПАКОВКА И ХРАНЕНИЕ Закись азота хранится в металлических баллонах вместимостью 10 л по 6,2 кг под давлением. Баллоны транспортируются в контейнерах и россыпью всеми видами транспорта в соответствии с правилами перевозки грузов, действующими на транспорте данного вида. ГАРАНТИЙНЫЙ СРОК ХРАНЕНИЯ — 5 ЛЕТ Зачем? Вы купили машину, которая, как вы думаете принадлежит к разряду быстрых. И внезапно замечаете, что есть машинки немного более резвые, чем ваша. Что делать? Продать старую и купить новую? Это решение для некоторых. Сделать тюнинг двигателя и ходовой? Это решение для других. Любой тюнинг — это соответствующее капиталовложение. Вы же потратили практически все деньги на покупку, регистрацию и прочую лабуду. И остались сзади. Что делать? Решение есть — поставить небольшую систему впрыска закиси азота. На обычную машину со стандартным компьютером. На автоматной HONDA RAFAGA с комплектом от ZEX на медицинском баллоне прибавка составила 1.7 сек на 400 метров. Соблюдая некоторые правила (включать не более 15 сек и затем охлаждать мотор), вы спокойно будете иметь запас по мощности 55-125 лошадиных сил. И в нужное время его применять. Если соберетесь продавать машину — проблем нет, система без следа демонтируется и легко ставится на другую. Как работает Закись азота под давлением в 1100 psi или 75 атм впрыскивается в камеры сгорания с помощью специальных форсунок. Вместе с закисью должно увеличится количество топлива впрыскиваемого в цилиндры. Это делается двумя способами. «Мокрый» способ — закись вместе с топливом впрыскивается в цилиндры через форсунки для закиси азота. Недостаток — необходимо контролировать давление в баллоне чтобы не обогатить смесью «Сухой» способ — закись впрыскивается через отдельную форсунку, а топливо через стандартные форсунки. Недостаток — ограниченная прибавочная мощность. Заправка Заправка — одна из самых главных проблем, с которой сталкиваются желающие поставить закись на свой автомобиль. Закись азота выпускается в России в баллонах по 6.5 кг вещества с давлением 45-50 атм. Это медицинские баллоны. Стоимость их низкая. Но есть проблемы с приобретением, так как до сих пор числится в разряде наркотиков. Первый и самый простой способ использовать эти баллоны. Для этого необходимо выточить бронзовую гайку под резьбу на русский баллон. В комплект ZEX входит контроллер, который позволяет ездить на том давлении, которое есть в баллоне, и иметь прибавку в мощности. В этом преимущество комплектов ZEX от конкурентов. При покупке обязательно надо проверять давление в баллонах, так как встречаются медицинские баллоны с очень низким давлением. Для этого очень хорошо иметь манометр в комплекте. Так же очень положительно влияет нагрев баллона до 30-35 градусов и расположение его в машине краном вниз. Второй способ — заправлять родной баллон, который идет в комплекте. Это можно делать с помощью соответствующего оборудования, например компрессора для заправки огнетушителей, и медицинских баллонов. Так же заправочную станцию можно приобрести от производителей систем впрыска закиси азота.
Методики исследований
АЗОТА ДИОКСИД: методики исследования в промышленных выборсах
| Номер методики | Диапазон |
|---|---|
| ПНДФ 12.10.1 | (1,0-200) мг/м3 |
| (фотометрический метод). № ЛПЭ-13/05 | — |
| Методика ООО «НПЦ«Аналитех» ДКИН.413411.001-МВИ | (0-200) млн-1 |
| РД 34.02.305-98, п.1.6 | (1,52 – 11200) мг/м3 |
| ФР.1.31.2004.01263 | (1,0-200) мг/м3 |
| МВИ № ПрВ 2000/6 (ФР.1.31.2015.20201) | — |
| Руководство по эксплуатации газоанализатора АГМ-51ОМС ДКИН.413411.001 РЭ | (0-200) млн-1 |
| СО 153–34.02.304-2003, п.1 | (1,52 – 11200) мг/м3 |
| МВИ-1-06 | (1-200) мг/м3 |
| ПНД Ф 13.1:2:3.19-98 | — |
| Газоанализатор универсальный ГАНК-4 . Паспорт КПГУ. Руководство по эксплуатации КПГУ | (0,02-1,0) мг/м3 |
| М-МВИ-173-06 ООО«Мониторинг», свид. № 242/007-06 от 25.01.2006 ФГУП им. Д.И.Менделеева». | (12-205) млн-1 |
| Руководство по эксплуатации газоанализатора ДАГ-500 | (0-1000) млн-1 |
| ФР 1.31.2011.11276 (М-18) | (0,1-140) мг/м3 |
| Руководство по эксплуатации ПЛЦК. 413411.001 РЭ многокомпонентного газоанализатора «Полар Т» | (20-1000) мг/м3 |
| Руководство по эксплуатации ЭКИТ5.940.000РЭ газоанализатора ЭЛАН | (0,21-10) мг/м3 |
| М-МВИ-172-06 (ФР.1.31.2011.11222) | (25-100) мг/м3 |
| Руководство по эксплуатации анализатора дымовых газов Testo 350 | (5-50000) ррm |
| ПНДФ 13.1.4-97 | (1-10000) мг/м3 |
| Газоанализатор «ГАНК–4» Руководство по эксплуатации КПГУ 413322 002 РЭ | (1 – 4000) мг/м3 с учетом разбавления |
| ГОСТ Р ИСО 10396-2006. инструкция по эксплуатации газоанализатора Testo-350XL. инструкция по эксплуатации газоанализатора ГАНК-4 | (0,02-6000) мг/м3 |
| ФР.1.31.2011.11222 (М-МВИ- 172-06) | (7,5-500) мг/м3 |
АЗОТА ДИОКСИД: методики исследования в атмосферном воздухе
| Номер методики | Диапазон |
|---|---|
| ФР.1.31.2009.06144 | (0,02-1,00) мг/м3 |
| Газоанализатор «ГАНК–4» Руководство по эксплуатации КПГУ 413322 002 РЭ | (0,02 – 1,0) мг/м3 |
| Руководство по эксплуатации ЭКИТ5.940.000РЭ газоанализатора ЭЛАН | (0,21-10) мг/м3 |
| РД 52.04.792-2014 (ФР.1.31.2015.19877) | (0,021-4,3) мг/м3 (разовая) |
| РД 52.04.186-89, п.5.2.1.4 | (0,02-1,40) мг/м3 |
| Руководство по эксплуатации газоан-ра «Элан» NO2 | (0,005-10) мг/м3 |
| МУ. Определение концентрации диоксида азота из одной пробы воздуха (фотометрическое определение с сульфаниловой кислотой и 1- нафтил амином). | (0,05-1,40) мг/м3 |
| Руководство по эксплуатации Газоанализатора универсального ГАНК-4 КГПУ 413322 002 РЭ | (0,02-10) мг/м3 |
| РД 52.04.792-2014 | (0,004-4,3) мг/м3 |
| ПНД Ф 13.1:2:3.19-98 | — |
АЗОТА ДИОКСИД: методики исследования в воздухе рабочей зоны
| Номер методики | Диапазон |
|---|---|
| (газоаналитической системы) фирмы «Thermo Environmental Instruments Inc», США, М-МВИ-103-02 | — |
| ПНД Ф 13.1:2:3.19-98 | — |
| Руководство по эксплуатации газоан-ра «Элан» NO2 | (0,005-10) мг/м3 |
| Руководство по эксплуатации ЭКИТ5.940.000РЭ газоанализатора ЭЛАН | (0,21-10) мг/м3 |
| МУ 4945-88 п.3.1 | (1-42) мг/м3 |
| Инструкция по эксплуатации газоанализатора ГАНК-4, Р 2.2.2006-05 прил. 9, МУ 2.2.5.2810-10 | (1-40) мг/м3 |
| Руководство по эксплуатации ГС серии ИГС-98 «Комета-М» ФГИМ 413415.001.500-006 РЭ | (2-30) мг/м3 |
| МУК 4.1.2473-09 | (1,0-20,0) мг/м3 |
Это интересно: Контузия (ушиб) головного мозга
Влияние NO на здоровье2 экспозиция
Даже небольшие ежедневные изменения NO2может вызвать изменения в функции легких. Хроническое воздействие NO2может вызывать респираторные эффекты, включая воспаление дыхательных путей у здоровых людей и усиление респираторных симптомов у людей, страдающих астмой. НЕТ2создает озон, который вызывает раздражение глаз и обостряет респираторные заболевания, что приводит к увеличению количества обращений в отделения неотложной помощи и госпитализаций по поводу респираторных заболеваний, особенно астмы.
Влияние токсичности на здоровье было изучено с помощью анкет и личных интервью, чтобы понять взаимосвязь между NO.2 и астма
Влияние загрязнителей воздуха в помещении на здоровье важно, поскольку большинство людей в мире проводят более 80% своего времени в помещении. Количество времени, проведенного в помещении, зависит от нескольких факторов, включая географический регион, виды деятельности, пол и другие переменные
Кроме того, поскольку изоляция дома улучшается, это может привести к большему удержанию загрязнителей воздуха в помещении, таких как NO.2. Что касается географического региона, распространенность астмы колеблется от 2 до 20% без четких указаний на то, что является движущей силой разницы. Это может быть результатом «гипотезы гигиены» или «западного образа жизни», который отражает представления о домах, которые хорошо изолированы и с меньшим количеством жителей. В другом исследовании изучалась взаимосвязь между воздействием азота в доме и респираторными симптомами и было обнаружено статистически значимое отношение шансов 2,23 (95% ДИ: 1,06, 4,72) среди пациентов с медицинским диагнозом астмы и воздействия газовой плиты.
Основной источник воздействия NO2использование газовых плит для приготовления пищи или отопления в домах. Согласно переписи 2000 года, более половины домохозяйств США используют газовые плиты и уровни содержания NO в помещениях.2в среднем как минимум в три раза выше в домах с газовыми плитами по сравнению с электрическими плитами, причем самые высокие уровни наблюдаются в многоквартирных домах. Воздействие НЕТ2особенно вреден для детей, страдающих астмой. Исследования показали, что дети с астмой, живущие в домах с газовыми плитами, имеют больший риск респираторных симптомов, таких как хрипы, кашель и стеснение в груди. Кроме того, использование газовой плиты было связано со снижением функции легких у девочек, страдающих астмой, хотя эта связь не была обнаружена у мальчиков. Использование вентиляции при работе газовых плит может снизить риск респираторных симптомов у детей, страдающих астмой.
В когортном исследовании с участием детей афроамериканского меньшинства из центральной части города Балтимора, чтобы определить, существует ли связь между NO2и астма для детей в возрасте от 2 до 6 лет, с существующим медицинским диагнозом астмы и одним посещением по поводу астмы, семьи с более низким социально-экономическим статусом чаще имели газовые плиты в своих домах. Исследование пришло к выводу, что более высокие уровни NO2в доме были связаны с более высоким уровнем респираторных симптомов среди исследуемой популяции. Это еще раз подтверждает, что НЕТ2 токсичность опасна для детей.
Клиническая информация, средства защиты, первоочередные действия в очаге
| Общий характер действия |
|
Средства защиты
Для химразведок и руководителя работ — ПДУ-3 (в течение 20 мин). Для аварийных бригад — изолирующий противогаз ИП-4М и спецодежда.
Химический очаг
Вид очага
Стойкий, замедленного действия. Газ тяжелее воздуха, может скапливаться в низких местах, подвалах, тоннелях.
Первоочередные мероприятия
Проведение поисково-спасательных работ в очаге, в том числе оказание первой медицинской помощи пострадавшим и их вынос (вывоз) на временные пункты сбора в оптимальные для спасения жизни и сохранения здоровья сроки, ведение разведки, обозначение и оцепление очага. Изолировать опасную зону в радиусе не менее 200 м. Откорректировать указанное расстояние по результатам химразведки. Держаться наветренной стороны. Избегать низких мест. В опасную зону входить в защитных средствах
Устранить течь с соблюдением мер предосторожности. При интенсивной утечке дать газу полностью выйти
Изолировать район, пока газ не рассеется. Не приближаться к емкостям. Охлаждать емкости водой с максимального расстояния. Не горючее, но способствует возгоранию других веществ. В случае возгорания в окрестностях разрешены все средства пожаротушения.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.)
nitrogen(IV) oxide (англ.) азота двуокись (рус.) азота диоксид (рус.) диазота тетраоксид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см3 | 1,491 |
| Плотность (состояние вещества – газ), кг/м3 | 2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание:
* — нет данных.
Литература[править | править код]
Оксиды
| H2O | ||||||||||||||||
| Li2OLiCoO2Li3PaO4Li5PuO6Ba2LiNpO6LiAlO2Li3NpO4Li2NpO4Li5NpO6LiNbO3 | BeO | B2O3 | С3О2C12O9COC12O12C4O6CO2 | N2ONON2O3N4O6NO2N2O4N2O5 | O | F | ||||||||||
| Na2ONaPaO3NaAlO2Na2PtO3 | MgO | AlOAl2O3NaAlO2LiAlO2AlO(OH) | SiOSiO2 | P4OP4O2P2O3P4O8P2O5 | S2OSOSO2SO3 | Cl2OClO2Cl2O6Cl2O7 | ||||||||||
| K2OK2PtO3KPaO3 | CaOCa3OSiO4CaTiO3 | Sc2O3 | TiOTi2O3TiO2TiOSO4CaTiO3BaTiO3 | VOV2O3V3O5VO2V2O5 | FeCr2O4CrOCr2O3CrO2CrO3MgCr2O4 | MnOMn3O4Mn2O3MnO(OH)Mn5O8MnO2MnO3Mn2O7 | FeCr2O4FeOFe3O4Fe2O3 | CoFe2O4CoOCo3O4CoO(OH)Co2O3CoO2 | NiONiFe2O4Ni3O4NiO(OH)Ni2O3 | Cu2OCuOCuFe2O4Cu2O3CuO2 | ZnO | Ga2OGa2O3 | GeOGeO2 | As2O3As2O4As2O5 | SeOCl2SeOBr2SeO2Se2O5SeO3 | Br2OBr2O3BrO2 |
| Rb2ORbPaO3Rb4O6 | SrO | Y2O3YOFYOCl | ZrO(OH)2ZrO2ZrOSZr2О3Сl2 | NbONb2O3NbO2Nb2O5Nb2O3(SO4)2LiNbO3 | Mo2O3Mo4O11MoO2Mo2O5MoO3 | TcO2Tc2O7 | Ru2O3RuO2Ru2O5RuO4 | RhORh2O3RhO2 | PdOPd2O3PdO2 | Ag2OAg2O2 | Cd2OCdO | In2OInOIn2O3 | SnOSnO2 | Sb2O3Sb2O4Hg2Sb2O7Sb2O5 | TeO2TeO3 | I2O4I4O9I2O5 |
| Cs2OCs2ReCl5O | BaOBaPaO3BaTiO3BaPtO3 | HfO(OH)2HfO2 | Ta2OTaOTaO2Ta2O5 | WO2Br2WO2WO2Cl2WOBr4WOF4WOCl4WO3 | Re2OReORe2O3ReO2Re2O5ReO3Re2O7 | OsOOs2O3OsO2OsO4 | Ir2O3IrO2 | PtOPt3O4Pt2O3PtO2K2PtO3Na2PtO3PtO3 | Au2OAuOAu2O3 | Hg2OHgO(Hg3O2)SO4Hg2O(CN)2Hg2Sb2O7Hg3O2Cl2Hg5O4Cl2 | Tl2OTl2O3 | Pb2OPbOPb3O4Pb2O3PbO2 | BiOBi2O3Bi2O4Bi2O5 | PoOPoO2PoO3 | At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2SLa2O3 | Ce2O3CeO2 | PrOPr2O2SPr2O3Pr6O11PrO2 | NdONd2O2SNd2O3NdHO | Pm2O3 | SmOSm2O3 | EuOEu3O4Eu2O3EuO(OH)Eu2O2S | Gd2O3 | Tb | Dy2O3 | Ho2O3Ho2O2S | Er2O3 | Tm2O3 | YbOYb2O3 | Lu2O2SLu2O3LuO(OH) | ||
| Ac2O3 | UO2UO3U3O8 | PaOPaO2Pa2O5PaOS | ThO2 | NpONpO2Np2O5Np3O8NpO3 | PuOPu2O3PuO2PuO3PuO2F2 | AmO2 | Cm2O3CmO2 | Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
Взаимодействие оксидов со средними солями
Чаще всего средние соли с оксидами не реагируют.
Однако следует выучить следующие исключения из данного правила, часто встречающиеся на экзамене.
Одним из таких исключений является то, что амфотерные оксиды, а также диоксид кремния (SiO2) при их сплавлении с сульфитами и карбонатами вытесняют из последних сернистый (SO2) и углекислый (CO2) газы соответственно. Например:
Al2O3 + Na2CO3 =to=> 2NaAlO2 + CO2
SiO2 + K2SO3 =to=> K2SiO3 + SO2
Также к реакциям оксидов с солями можно условно отнести взаимодействие сернистого и углекислого газов с водными растворами или взвесями соответствующих солей — сульфитов и карбонатов, приводящее к образованию кислых солей:
Na2CO3 + CO2 + H2O = 2NaHCO3
CaCO3 + CO2 + H2O = Ca(HCO3)2
Также сернистый газ при пропускании его через водные растворы или взвеси карбонатов вытесняет из них углекислый газ благодаря тому, что сернистая кислота является более сильной и устойчивой кислотой, чем угольная:
K2СO3 + SO2 = K2SO3 + CO2
Химические свойства
Основные реакции оксидов азота с простыми и сложными веществами приведены в таблице.
|
Оксиды |
Реакции |
Уравнения |
|
N2O |
При нагревании разлагается. Окисляет неметаллы. Проявляет свойства восстановителя с сильными окислителями. Реагирует с аммиаком и его производными. Не образует солей. Не реагирует с водой, щелочами, кислотами |
– 2N2O → 2N2 + O2; – 2N2O + C → 2N2 + CO2; – 5N2O + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O; – 2NH3 + N2O → NH4N3 + H2O; – 2NaNH2 + N2O → NaN3 + NaOH + NH3 |
|
NO |
Окисляется до диоксида азота на воздухе при нормальных условиях. Взаимодействует с галогенами. В присутствии сильного восстановителя проявляет окислительные свойства. Не образует соли, плохо растворим в воде |
– 2NO + O2 → 2NO2; – 2NO + Cl2 → 2NOCl; – 2SO2 + 2NO → 2SO3 + N2 |
|
N2O3 |
Разлагается при нагревании. Реагирует с водой с образованием азотистой кислоты. Растворим в щелочах |
– N2O3 → NO + NO2; – N2O3 + H2O → 2HNO2; – N2O3 + 2KOH → 2KNO2 + H2O |
|
NO2 |
Реагирует с неметаллами, металлами, галогенами, водой. Окисляет оксиды серы. Растворяется в щелочах |
– 10NO2 + 8P → 4P2O5 + 5N2; – 4NO2 + Zn → Zn(NO3)2 + 2NO; – 2NO2 + 2Cl2 → NOCl + NO2Cl + Cl2O; – 2NO2 + H2O → HNO3 + HNO2; – NO2 + SO2 → SO3 + NO; – 2NO2 + 2KOH → KNO3 + KNO2 + H2O |
|
N2O5 |
Быстро разлагается с взрывом. Растворяется в воде, щелочах |
– 2N2O5 → 4NO2 + O2; – N2O5 + H2O 2HNO3; – N2O5 + 2NaOH → 2NaNO3 + H2O |
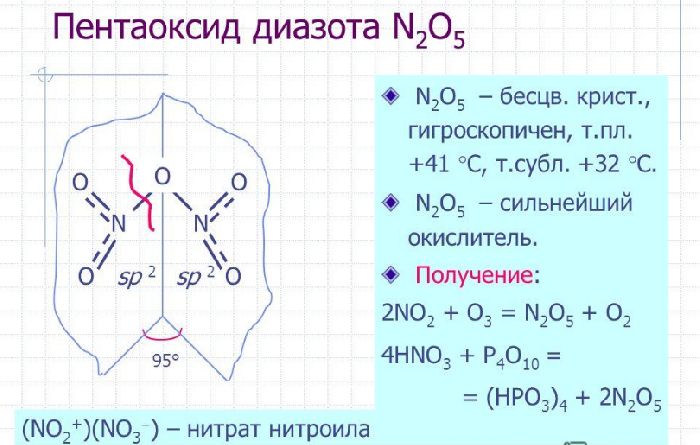
Рис. 3. Пентаоксид диазота или оксид азота (V).
Оксиды используются для получения азотной кислоты. N2O используется в качестве наркоза.
Что мы узнали?
Из темы урока узнали, что азот может образовывать пять стабильных оксидов, проявляя переменную валентность I, II, III, IV, V. Только один оксид (NO) можно получить непосредственным взаимодействием азота и кислорода при нагревании или под воздействием электричества. Остальные оксиды выделяются из солей аммония и азотной кислоты. Большинство оксидов – токсичные газы, способные сжижаться. Оксиды реагируют с металлами, неметаллами, щелочами, оксидами.
Тест по теме
-
Вопрос 1 из 10
Начать тест(новая вкладка)
Получение в природе и промышленности
В природе азот встречается преимущественно в чистом виде. Во время грозы азот и кислород вступают во взаимодействие при высокой температуре. Образуется монооксид: N2+O2 = 2NO.
В промышленных условиях получают следующие соединения:

- При разложении нитрата аммония образуется оксид азота, формула которого выглядит как N2O. Уравнение химической реакции записывается следующим образом: NH4NO3 → N2O+2H2O.
- На производстве получение оксида азота (I) происходит путём окисления аммиака. Химический процесс нуждается в присутствии катализатора, в роли которого выступает платина.
- В лабораторных условиях монооксид получают путём взаимодействия меди и разбавленной азотной кислоты. Другой способ получения — окисление хлорида железа или йодоводорода в результате взаимодействия с азотной кислотой.
- Двуокись получается в результате взаимодействия монооксида с атомами кислорода.
- Лабораторным путём NO2 (IV) получается при взаимодействии концентрированной азотной кислоты с медью. Второй вариант — разложение нитрата меди или свинца.
- Азотистый ангидрид можно получить из оксидов при низкой температуре.
Живые организмы также вырабатывают соединения азота. Растения способны вырабатывать монооксид азота несколькими способами:
- С помощью фермента синтазы и аминокислоты аргинина. Хотя некоторые учёные считают, что в растительных клетках нет прямых аналогов этого фермента.
- С помощью фермента нитрат-редуктазы, который находится в клеточных оболочках. Вещество способно восстанавливать нитраты и нитриты, которые растение получает из почвы.
- Посредством транспортировки электронов в митохондриях.
- Путём окисления аммиака или восстановления нитратов и нитритов без участия катализаторов.
Химические свойства[править | править код]
Кислотный оксид. N2O3 подвержен термической диссоциации:
-
- N2O3→NO+NO2{\displaystyle {\mathsf {N_{2}O_{3}\rightarrow NO+NO_{2}}}}
При 25 °C содержание N2O3 в смеси газов составляет около 10,5 %. Жидкий оксид азота(III) синего цвета, он также частично диссоциирован.
Являясь азотистым ангидридом, при взаимодействии с водой N2O3 даёт азотистую кислоту:
-
- N2O3+H2O→2HNO2{\displaystyle {\mathsf {N_{2}O_{3}+H_{2}O\rightarrow 2HNO_{2}}}}
При взаимодействии с растворами щелочей образуются соответствующие нитриты:
-
- N2O3+2KOH→2KNO2+H2O{\displaystyle {\mathsf {N_{2}O_{3}+2KOH\rightarrow 2KNO_{2}+H_{2}O}}}
Нитриты и нитраты
Hитраткалия KNO3Техническое название калийная, или индийская соль, селитра. Белый, плавится без разложения при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо-эффектом, = -36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO2, в щелочной среде до NH3). Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений.
2KNO3 = 2KNO2 + O2 (400- 500 ˚C)
KNO3 + 2H (Zn, разб. HCl) = KNO2 + H2O
2 KNO3 + 3C (графит) + S = N2 + 3CO2 + K2S (сгорание)
KNO3 + Pb = KNO2 + PbO (350 — 400 ˚C)
KNO3 + 2KOH + MnO2 = K2MnO4 + KNO2 + H2O (350 — 400 ˚C)
Получение: в промышленности4KOH (гор.) + 4NO2 + O2 = 4KNO3 + 2H2O
и в лаборатории:KCl + AgNO3 = KNO3 + AgCl↓
Формулы оксидов азота
Ниже приведены обозначения наиболее значимых соединений элемента N.
Это прежде всего оксид азота, формула которого состоит из двух химических знаков — N и O. За ними ставятся индексы, в зависимости от степени окисления атомов.
- Азота одновалентного оксид имеет формулу N2O. В нем атом N заряжен +1.
- Азота двухвалентного оксид имеет формулу NO. В нем атом N заряжен +2.
- Азота трехвалентного оксид имеет формулу N2O3. В нем атом N заряжен +3.
- Четырехвалентный оксид азота, формула которого NO2, имеет заряд атома N +4.
- Пятивалентное кислородное соединение обозначается как N2O5. В нем атом N заряжен +5.