Изохорная теплоемкость
Содержание:
- Изохорная теплоемкость
- Виды теплопередачи
- Удельная и молярная теплоёмкость
- Изобарная и изохорная теплоемкость
- Литература
- Определение
- Изохорная теплоемкость
- Таблица удельной теплоемкости пищевых продуктов
- Краткая теория и методика выполнения работы
- Формулы изохорной и изобарной теплоемкостей воздуха
- Удельная и молярная теплоёмкость
- Формулы изохорной и изобарной теплоемкостей воздуха
- Теплоемкость и ее виды
- Теплоёмкость идеального газа в изопроцессах
- Внутренняя энергия газа
Изохорная теплоемкость
| Изменение энтропии ds. |
Вычислим изохорную теплоемкость влажного водяного пара, имеющего степень сухости х 0 575 при давлении 1 бар. Поданным опытов А. М. Керимова, теплоемкости су и су при давлении р 1 бар равны соответственно 1 007 и 16 95 ккал / кг. Непосредственное вычисление по таблицам водяного пара дает значение cv 10 1 ккал / ( кг — град), практически не отличающееся от экспериментального.
Так как изохорная теплоемкость влажного пара cv — величина положительная, то это значит, что знаки дифференциалов dp и dv противоположны.
Так как изохорная теплоемкость влажного пара cv — величина положительная, то величины dp и dv — противоположны. Таким образом, изоэнтропическое расширение влажного пара обусловливает уменьшение его давления и температуры, а изоэнтропическое сжатие — возрастание их.
Так как изохорная теплоемкость влажного пара с есть положительная величина, то отсюда следует, что знаки дифференциалов dp и dv противоположны.
Результаты исследований изохорной теплоемкости на изохорах, проведенные вдали от критической точки v 2 67; 2 92; 4 95; 5 96; 9 92 см3 / г, показывают, что теплоемкость cv с увеличением температуры монотонно увеличивается, достигает некоторого своего максимального значения при определенной температуре, затем происходит скачкообразное ее уменьшение, что является признаком совершения перехода из двухфазного состояния в однофазное через пограничную кривую. В однофазной области в исследованном температурном интервале теплоемкость с на изохорах раствора данной концентрации с увеличением температуры монотонно уменьшается. Установлено, что величины теплоемкости сс в двухфазной области и их разрыв при переходе в однофазное состояние с ростом значения v возрастают.
Экспериментальное исследование изохорной теплоемкости некоторых углеводородов и спиртов.
Характер сингулярности изохорной теплоемкости одноком понентной жидкости таков, что до сих пор можно встретит утверждения, основанные на рассмотрении искаженного участ ка аномалии, об отсутствии расходимости этой величины в кри тической точке.
Уравнение для изохорной теплоемкости са записывается следующим образом ( г V сопз.
Следовательно, изохорную теплоемкость можно определить как количество теплоты, которое необходимо подвести к системе при постоянном объеме, чтобы повысить ее температуру на один градус.
Здесь Су — изохорная теплоемкость в идеальном состоянии, отнесенная к одной частице газа; Л, Л / — число положительных ионов и электронов.
Покажите, что изохорная теплоемкость этого газа не зависит от объема.
С г — изохорная теплоемкость газа; i CPICV; Pt и Р2 — начальное и конечное давление; СР — изобарная теплоемкость газа; TI и TZ — начальная и конечная температура; Vi и У2 — — начальный и конечный объем.
| Зависимость изохорной теплоемкости от температуры для простых кристаллических веществ.| Изобарная теплоемкость металлов. |
Таким образом, изохорная теплоемкость кристалла простого вещества должна быть равна 25 Дж / ( К-моль), Это правило соблюдается только при достаточно высоких температурах для многих металлов, начиная с четвертого периода системы элементов. Чем больше атомная масса элемента, тем при более низкой температуре достигается теоретическое значение теплоемкости. Теплоемкость алмаза не достигает этого значения даже при 1200 С.
Виды теплопередачи
Здесь все совсем несложно, их всего три: теплопроводность, конвекция и излучение.
Теплопроводность
Тот вид теплопередачи, который можно охарактеризовать, как способность тел проводить энергию от более нагретого тела к менее нагретому.
Речь о том, чтобы передать тепло с помощью соприкосновения. Признавайтесь, грелись же когда-нибудь возле батареи. Если вы сидели к ней вплотную, то согрелись вы благодаря теплопроводности. Обниматься с котиком, у которого горячее пузо, тоже эффективно.
Порой мы немного перебарщиваем с возможностями этого эффекта, когда на пляже ложимся на горячий песок. Эффект есть, только не очень приятный. Ну а ледяная грелка на лбу дает обратный эффект — ваш лоб отдает тепло грелке.
Конвекция
Когда мы говорили о теплопроводности, мы приводили в пример батарею. Теплопроводность — это когда мы получаем тепло, прикоснувшись к батарее. Но все вещи в комнате к батарее не прикасаются, а комната греется. Здесь вступает конвекция.
Дело в том, что холодный воздух тяжелее горячего (холодный просто плотнее). Когда батарея нагревает некий объем воздуха, он тут же поднимается наверх, проходит вдоль потолка, успевает остыть и спуститься обратно вниз — к батарее, где снова нагревается. Таким образом, вся комната равномерно прогревается, потому что все более горячие потоки сменяют все менее холодные.
Излучение
Пляж мы уже упоминали, но речь шла только о горячем песочке. А вот тепло от солнышка — это излучение. В этом случае тепло передается через волны.
Если мы греемся у камина, то получаем тепло конвекцией или излучением?
Обоими способами. То тепло, которое мы ощущаем непосредственно от камина (когда лицу горячо, если вы расположились слишком близко к камину) — это излучение. А вот прогревание комнаты в целом — это конвекция.
Удельная и молярная теплоёмкость
Молярная теплоёмкость — теплоёмкость 1 моля вещества :
- CM=Cν=1νδQΔT,{\displaystyle C_{M}={\frac {C}{\nu }}={\frac {1}{\nu }}{\frac {\delta Q}{\Delta T}},}
где ν=mM,{\displaystyle \nu =m/M,} m{\displaystyle m} — масса, M{\displaystyle M} — молярная масса вещества.
Теплоёмкость единичной массы вещества называется удельной теплоёмкостью и, в системе СИ, измеряется в Дж/(кг·К).
Формула расчёта удельной теплоёмкости:
- где c — удельная теплоёмкость, m — масса нагреваемого (охлаждающегося) вещества.
Изобарная и изохорная теплоемкость
В физике теплоемкостью называется количество теплоты, которое необходимо предоставить изучаемой системе, чтобы нагреть ее на один кельвин. Справедливо также и обратное определение, то есть теплоемкость — это количество теплоты, которое система выделяет при охлаждении на один кельвин.
Проще всего для системы определить изохорную теплоемкость. Под ней понимают теплоемкость при постоянном объеме. Поскольку система в таких условиях работу не совершает, то вся энергия расходуется на повышение внутренних энергетических запасов. Обозначим изохорную теплоемкость символом CV, тогда можно записать:
То есть изменение внутренней энергии системы прямо пропорционально изменению ее температуры. Если сравнить это выражение, с записанным в предыдущем пункте равенством, то приходим к формуле для CV в идеальном газе:
Данной величиной на практике неудобно пользоваться, поскольку она зависит от количества вещества в системе. Поэтому было введено понятие удельной изохорной теплоемкости, то есть величины, которую рассчитывают либо на 1 моль газа, либо на 1 кг. Обозначим первую величину символом CVn, вторую — символом CVm. Для них можно записать такие формулы:
Здесь M — молярная масса.
Изобарной называется теплоемкость при поддержании постоянного давления в системе. Примером такого процесса является расширение газа в цилиндре под поршнем при его нагревании. В отличие от изохорного, во время изобарного процесса подводимое к системе тепло расходуется на повышение внутренней энергии и на выполнение механической работы, то есть:
Энтальпия изобарного процесса представляет собой произведение изобарной теплоемкости на изменение температуры в системе, то есть:
Если рассмотреть расширение при постоянном давлении 1 моль газа, то первое начало термодинамики запишется в виде:
Последнее слагаемое получено из уравнения Клапейрона-Менделеева. Из этого равенства следует связь между изобарной и изохорной теплоемкостями:
Для идеального газа удельная молярная теплоемкость при постоянном давлении всегда больше соответствующей изохорной характеристики на величину R=8,314 Дж/(моль*К).
Литература
- Артемов А. В. Физическая химия. — М.: Академия, 2013. — 288 с. — (Бакалавриат). — ISBN 978-5-7695-9550-9.
- (недоступная ссылка)
- (недоступная ссылка)
- (недоступная ссылка)
- Ипполитов Е. Г., Артемов А. В., Батраков В.В. Физическая химия / Под ред. Е. Г. Ипполитова. — М.: Академия, 2005. — 448 с. — (Высшее профессиональное образование). — ISBN 978-5-7695-1456-6.
- (недоступная ссылка)
- Лифшиц Е. М. // Физическая энциклопедия / Ред. А. М. Прохоров. — М.: Большая Советская Энциклопедия, 1992. — Т. 5. — С. 77–78.
- Лифшиц Е. М. // Большая советская энциклопедия / Ред. А. М. Прохоров. — 3-е издание. — М.: Большая Советская Энциклопедия, 1976. — Т. 25. — С. 451.
- Сивухин Д. В. Общий курс физики. — Издание 5-е, исправленное. — М.: Физматлит, 2006. — Т. II. Термодинамика и молекулярная физика. — 544 с. — ISBN 5-9221-0601-5.
- // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 54.
Определение
Удельная теплоемкость вещества, обычно обозначаемая как c{ displaystyle c}, — теплоемкость C{ displaystyle C} образца вещества, деленного на массу M{ displaystyle M} образца:
- c=CM=1M⋅dQdТ{ displaystyle c = { frac {C} {M}} = { frac {1} {M}} cdot { frac { mathrm {d} Q} { mathrm {d} T}}}
куда dQ{ displaystyle mathrm {d} Q} представляет количество тепла, необходимое для равномерного повышения температуры образца с небольшим шагом dТ{ displaystyle mathrm {d} T}.
Как и теплоемкость объекта, удельная теплоемкость вещества может варьироваться, иногда существенно, в зависимости от начальной температуры. Т{ displaystyle T} образца и давление п{ displaystyle p} применяется к нему. Следовательно, ее следует рассматривать как функцию c(п,Т){ displaystyle c (p, T)} этих двух переменных.
Эти параметры обычно указываются при указании удельной теплоемкости вещества. Например, «Вода (жидкость): cп{ displaystyle c_ {p}} = 4185,5 Дж / К / кг (15 ° C, 101,325 кПа) » Если не указано иное, опубликованные значения удельной теплоемкости c{ displaystyle c} как правило, действительны для некоторых стандартные условия по температуре и давлению.
Однако зависимость c{ displaystyle c} на начальную температуру и давление часто можно игнорировать в практических контекстах, например при работе в узких диапазонах этих переменных. В этих контекстах обычно опускают квалификатор (п,Т){ displaystyle (p, T)}, и аппроксимирует теплоемкость константой c{ displaystyle c} подходит для этих диапазонов.
Удельная теплоемкость — это интенсивное свойство вещества, внутренняя характеристика, которая не зависит от размера или формы рассматриваемого количества. (Квалификатор «специфический» перед экстенсивным свойством часто указывает на интенсивное свойство, производное от него.)
Вариации
Введение тепловой энергии в вещество, помимо повышения его температуры, обычно вызывает увеличение его объема и / или давления, в зависимости от того, как удерживается образец. Выбор последнего влияет на измеренную удельную теплоемкость даже при том же начальном давлении. п{ displaystyle p} и начальная температура Т{ displaystyle T}. Широко используются два конкретных варианта:
- Если давление поддерживается постоянным (например, при атмосферном давлении окружающей среды), а образец расширяется, расширение вызывает работай поскольку сила давления смещает корпус или окружающую жидкость. Эта работа должна производиться за счет поставляемой тепловой энергии. Полученная таким образом удельная теплоемкость называется измеренной. при постоянном давлении (или же изобарический), и часто обозначается cп{ displaystyle c_ {p}}, cп{ displaystyle c _ { mathrm {p}}}, так далее.
- С другой стороны, если расширение предотвращается — например, за счет достаточно жесткого корпуса или увеличения внешнего давления, чтобы противодействовать внутреннему, — работа не создается, и тепловая энергия, которая пошла бы в него, должна вместо этого способствовать внутренняя энергия образца, в том числе повышение его температуры на дополнительную величину. Полученная таким образом удельная теплоемкость называется измеренной. при постоянной громкости (или же изохорный) и обозначили cV{ displaystyle c_ {V}}, cv{ displaystyle c_ {v}} cv{ displaystyle c _ { mathrm {v}}}, так далее.
Значение cV{ displaystyle c_ {V}} обычно меньше, чем значение cп{ displaystyle c_ {p}}. Эта разница особенно заметна для газов, где значения при постоянном давлении обычно на 30–66,7% больше, чем при постоянном объеме. Следовательно коэффициент теплоемкости газов обычно составляет от 1,3 до 1,67.
Применимость
Удельную теплоемкость можно определить и измерить для газов, жидкостей и твердых тел довольно общего состава и молекулярной структуры. К ним относятся газовые смеси, растворы и сплавы или гетерогенные материалы, такие как молоко, песок, гранит и бетон, если рассматривать их в достаточно большом масштабе.
Удельная теплоемкость также может быть определена для материалов, которые изменяют состояние или состав при изменении температуры и давления, если изменения обратимы и постепенны. Таким образом, например, концепции могут быть определены для газа или жидкости, которые диссоциируют при повышении температуры, до тех пор, пока продукты диссоциации быстро и полностью рекомбинируют при падении.
Удельная теплоемкость не имеет значения, если вещество претерпевает необратимые химические изменения или если есть изменение фазы, например, плавление или кипение при резкой температуре в диапазоне температур, охватываемых измерением.
Изохорная теплоемкость
|
Изменение энтропии ds. |
Вычислим изохорную теплоемкость влажного водяного пара, имеющего степень сухости х 0 575 при давлении 1 бар. Поданным опытов А. М. Керимова, теплоемкости су и су при давлении р 1 бар равны соответственно 1 007 и 16 95 ккал / кг. Непосредственное вычисление по таблицам водяного пара дает значение cv 10 1 ккал / ( кг — град), практически не отличающееся от экспериментального.
Так как изохорная теплоемкость влажного пара cv — величина положительная, то это значит, что знаки дифференциалов dp и dv противоположны.
Так как изохорная теплоемкость влажного пара cv — величина положительная, то величины dp и dv — противоположны. Таким образом, изоэнтропическое расширение влажного пара обусловливает уменьшение его давления и температуры, а изоэнтропическое сжатие — возрастание их.
Так как изохорная теплоемкость влажного пара с есть положительная величина, то отсюда следует, что знаки дифференциалов dp и dv противоположны.
Результаты исследований изохорной теплоемкости на изохорах, проведенные вдали от критической точки v 2 67; 2 92; 4 95; 5 96; 9 92 см3 / г, показывают, что теплоемкость cv с увеличением температуры монотонно увеличивается, достигает некоторого своего максимального значения при определенной температуре, затем происходит скачкообразное ее уменьшение, что является признаком совершения перехода из двухфазного состояния в однофазное через пограничную кривую. В однофазной области в исследованном температурном интервале теплоемкость с на изохорах раствора данной концентрации с увеличением температуры монотонно уменьшается. Установлено, что величины теплоемкости сс в двухфазной области и их разрыв при переходе в однофазное состояние с ростом значения v возрастают.
Экспериментальное исследование изохорной теплоемкости некоторых углеводородов и спиртов.
Характер сингулярности изохорной теплоемкости одноком понентной жидкости таков, что до сих пор можно встретит утверждения, основанные на рассмотрении искаженного участ ка аномалии, об отсутствии расходимости этой величины в кри тической точке.
Уравнение для изохорной теплоемкости са записывается следующим образом ( г V сопз.
Следовательно, изохорную теплоемкость можно определить как количество теплоты, которое необходимо подвести к системе при постоянном объеме, чтобы повысить ее температуру на один градус.
Здесь Су — изохорная теплоемкость в идеальном состоянии, отнесенная к одной частице газа; Л, Л / — число положительных ионов и электронов.
Покажите, что изохорная теплоемкость этого газа не зависит от объема.
С г — изохорная теплоемкость газа; i CPICV; Pt и Р2 — начальное и конечное давление; СР — изобарная теплоемкость газа; TI и TZ — начальная и конечная температура; Vi и У2 — — начальный и конечный объем.
|
Зависимость изохорной теплоемкости от температуры для простых кристаллических веществ.| Изобарная теплоемкость металлов. |
Таким образом, изохорная теплоемкость кристалла простого вещества должна быть равна 25 Дж / ( К-моль), Это правило соблюдается только при достаточно высоких температурах для многих металлов, начиная с четвертого периода системы элементов. Чем больше атомная масса элемента, тем при более низкой температуре достигается теоретическое значение теплоемкости. Теплоемкость алмаза не достигает этого значения даже при 1200 С.
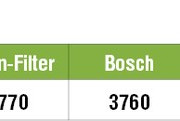
Таблица удельной теплоемкости пищевых продуктов
В таблице приведены значения средней удельной теплоемкости пищевых продуктов (овощей, фруктов, мяса, рыбы, хлеба, вина и т. д.) в диапазоне температуры 5…20°С и нормальном атмосферном давлении.
| Продукты | C, Дж/(кг·К) |
|---|---|
| Абрикосы | 3770 |
| Ананасы | 3684 |
| Апельсины | 3730 |
| Арбуз | 3940 |
| Баклажаны | 3935 |
| Брюква | 3810 |
| Ветчина | 2140 |
| Вино крепленое | 3690 |
| Вино сухое | 3750 |
| Виноград | 3550 |
| Вишня | 3650 |
| Говядина и баранина жирная | 2930 |
| Говядина и баранина маложирная | 3520 |
| Горох | 3684 |
| Грибы свежие | 3894 |
| Груши | 3680 |
| Дрожжи прессованные | 1550…3516 |
| Дыни | 3850 |
| Ежевика | 3642 |
| Земляника | 3684 |
| Зерно пшеничное | 1465…1549 |
| Кабачки | 3900 |
| Капуста | 3940 |
| Картофель | 3430 |
| Клубника | 3810 |
| Колбасы | 1930…2810 |
| Крыжовник | 3890 |
| Лимоны | 3726 |
| Лук | 2638 |
| Макароны не приготовленные | 1662 |
| Малина | 3480 |
| Мандарины | 3770 |
| Маргарин сливочный | 2140…3182 |
| Масло анисовое | 1846 |
| Масло мятное | 2080 |
| Масло сливочное | 2890…3100 |
| Масло сливочное топленое | 2180 |
| Мед | 2300…2428 |
| Молоко сухое | 1715…2090 |
| Морковь | 3140 |
| Мороженое (при -10С) | 2175 |
| Мука | 1720 |
| Огурцы | 4060 |
| Пастила | 2090 |
| Патока | 2512…2700 |
| Перец сладкий | 3935 |
| Печенье | 2170 |
| Помидоры | 3980 |
| Пряники | 1800…1930 |
| Редис | 3970 |
| Рыба жирная | 2930 |
| Рыба нежирная | 3520 |
| Салат зеленый | 4061 |
| Сало топленое | 2510 |
| Сахар кусковой | 1340 |
| Сахарный песок | 720 |
| Свекла | 3340 |
| Свинина жирная | 260 |
| Свинина нежирная | 3010 |
| Слива | 3750 |
| Сметана | 3010 |
| Смородина черная | 3740 |
| Сода | 2256 |
| Соль поваренная (2% влажности) | 920 |
| Спаржа | 3935 |
| Сыр жирный | 2430 |
| Творог | 3180 |
| Телятина жирная | 3180 |
| Телятина нежирная | 3520 |
| Тесто заварное | 2910 |
| Тыква | 3977 |
| Хлеб (корка) | 1680 |
| Хлеб (мякиш) | 2800 |
| Черешня | 3770 |
| Чернослив | 3181 |
| Чеснок | 3140 |
| Шоколад | 2340…2970 |
| Шпинат | 3977 |
| Яблоки | 3760 |
| Яйцо куриное | 3180 |
Кроме таблиц удельной теплоемкости, вы также можете ознакомиться с подробнейшей таблицей плотности веществ и материалов, которая содержит данные по величине плотности более 500 веществ (металлов, пластика, резины, продуктов, стекла и др.).
- Исаченко В. П., Осипова В. А., Сукомел А. С. Теплопередача. Учебник для вузов, изд. 3-е, перераб. и доп. — М.: «Энергия», 1975.
- Тепловые свойства металлов и сплавов. Справочник. Лариков Л. Н., Юрченко Ю. Ф. — Киев: Наукова думка, 1985. — 439 с.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др. Под ред. И. С. Григорьева — М.: Энергоатомиздат, 1991. — 1232 с.
- Еремкин А. И., Королева Т. И. Тепловой режим зданий: Учебное пособие. — М.: Издательство ACB, 2000 — 368 с.
- Кириллов П. Л., Богословская Г. П. Тепломассобмен в ядерных энергетических установках: Учебник для вузов.
- Михеев М. А., Михеева И. М. Основы теплопередачи. Изд. 2-е, стереотип. М.: «Энергия», 1977. — 344 с. с ил.
- Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Франчук А. У. Таблицы теплотехнических показателей строительных материалов, М.: НИИ строительной физики, 1969 — 142 с.
- Добрынин В. М., Вендельштейн Б. Ю., Кожевников Д. А. Петрофизика: Учеб. для вузов. 2-ое изд. перераб. и доп. под редакцией доктора физико-математических наук Д. А. Кожевникова — М.: ФГУП Издательство «Нефть и газ» РГУ нефти и газа им. И.М. Губкина, 2004. — 368 с., ил.
- В. Блази. Справочник проектировщика. Строительная физика. М.: Техносфера, 2005. — 536 с.
- Енохович А. С. Справочник по физике. М.: «Просвещение», 1978. — 415 с. с ил.
- Строительная теплотехника СНиП II-3-79. Минстрой России — Москва 1995.
- Мустафаев Р. А. Теплофизические свойства углеводородов при высоких параметрах состояния. М.: Энергоатомиздат, 1991. — 312 с.
- Новиченок Н. Л., Шульман З. П. Теплофизические свойства полимеров. Минск, «Наука и техника» 1971. — 120 с.
- Шелудяк Ю. Е., Кашпоров Л. Я. и др. Теплофизические свойства компонентов горючих систем. М., 1992. — 184 с.
Краткая теория и методика выполнения работы
Удельной
теплоемкостью
вещества называется величина, равная
количеству теплоты, которую необходимо
сообщить единице массы вещества для
увеличения ее температуры на один градус
Кельвина:
. (4.1)
Теплоемкость
одного моля вещества называется молярной
теплоемкостью:
, (4.2)
где
m – масса, µ – молярная масса вещества,– число молей газа.
Значение
теплоемкости газов зависит от условий
их нагревания. В соответствии с первым
законом термодинамики количество
теплоты,
сообщенное системе, расходуется на
увеличение ее внутренней энергиии на совершение системой работыпротив внешних сил:
. (4.3)
Изменение
внутренней энергии идеального газа в
случае изменения его температурыравно:
, (4.4)
здесь
– число степеней свободы молекулы газа,
под которым подразумевается число
независимых координат, полностью
определяющих положение молекулы в
пространстве;– универсальная газовая постоянная.
При
расширении газа система совершает
работу:
. (4.5)
Если
газ нагревать при постоянном объеме
(),
тои, согласно (4.3), все полученное газом
количество теплоты расходуется только
на увеличение его внутренней энергии.
Следовательно, учитывая (4.4), молярная
теплоемкость идеального газа при
постоянном объеме будет равна:
. (4.6)
Если
газ нагревать при постоянном давление
(),
то полученное газом количество теплоты
расходуется на увеличение его внутренней
энергиии совершение газом работы:
.
Тогда
молярная теплоемкость идеального газа
при постоянном давлении определяется
следующим образом:
. (4.7)
Используя
уравнение состояния идеального газа
(уравнение Клапейрона–Менделеева),
можно показать, что для одного моля газа
справедливо соотношение:
,
поэтому:
.
Последнее выражение
называют уравнением Майера. Из него,
учитывая (4.6), получаем:
. (4.8)
Отношение
теплоемкостейобозначаюти называют показателем адиабаты или
коэффициентом Пуассона:
. (4.9)
Адиабатным
называется процесс, протекающий в
термоизолированной системе, т.е. без
теплообмена с окружающей средой,.
На
практике он может быть осуществлен в
системе, окруженной теплоизоляционной
оболочкой, но поскольку для теплообмена
необходимо некоторое время, то адиабатным
можно считать также процесс, который
протекает так быстро, что система не
успевает вступить в теплообмен с
окружающей средой.
Первый
закон термодинамики для адиабатного
процесса имеет вид.
Знак минус говорит о том, что при
адиабатном процессе система может
совершать работу только за счет внутренней
энергии. С учетом (4.4)–(4.6) имеем:
. (4.10)
Продифференцировав
уравнение Клапейрона–Менделеева,
получим:
.
Выразим
из негои подставим в формулу (4.10):
.
Выразивиз уравнения Майера и учитывая соотношение
(4.8), получим:
.
Интегрируя
данное дифференциальное уравнение при
условииполучим выражение:
.
(4.11)
Уравнение
(4.11) называется уравнением адиабаты или
уравнением Пуассона.
Метод
определения показателя адиабаты,
предложенный Клеманом и Дезормом (1819
г.), основывается на изучении параметров
некоторой массы газа, переходящей из
одного состояния в другое двумя
последовательными процессами –
адиабатным и изохорным. Эти процессы
на диаграмме–(рис. 4.1) изображены кривыми соответственно
1–2 и 2–3.
Если
в сосуд, соединенный с дифференциальным
датчиком давления, накачать воздух и
подождать до установления теплового
равновесия с окружающей средой, то в
этом начальном состоянии 1 газ имеет
параметры,,,
причем температура газа в сосуде равна
температуре окружающей среды,
а давлениенемного больше атмосферного.
Если
теперь на короткое время соединить
сосуд с атмосферой, то произойдет
адиабатное расширение воздуха. При этом
воздух в сосуде перейдет в состояние
2, его давление понизится до атмосферного.
Масса воздуха, оставшегося в сосуде,
которая в состоянии 1 занимала часть
объема сосуда, расширяясь, займет весь
объем.
При этом температура воздуха, оставшегося
в сосуде, понизится до.
Поскольку процесс 1–2 – адиабатный, к
нему можно применить уравнение Пуассона
(4.11):
или.
Отсюда:
. (4.12)
После
кратковременного соединения сосуда с
атмосферой охлажденный из-за адиабатного
расширения воздух в сосуде будет
нагреваться (процесс 2–3) до температуры
окружающей средыпри постоянном объеме.
При этом давление в сосуде поднимется
до.
Поскольку
процесс 2–3 – изохорный, к нему можно
применить закон Шарля:
или
. (4.13)
Из уравнений (4.12)
и (4.13) получим:
.
Прологарифмируем
это выражение:
.
Поскольку
избыточные давленияиочень малы по сравнению с атмосферным
давлением,
а также учитывая, что при,
будем иметь:
.
Откуда:
. (4.14)
Избыточные
давленияиизмеряют с помощью дифференциального
датчика давления.
Формулы изохорной и изобарной теплоемкостей воздуха

Сначала рассмотрим изохорную величину. Обозначим ее CV. Первое начало термодинамики, которое следует из закона сохранения энергии, для изохорного процесса выглядит следующим образом:
То есть все тепло H, подводимое к системе, идет на увеличение ее внутренней энергии. Изменение величины U можно записать так:
С другой стороны, если воспользоваться универсальным уравнением состояния идеальной газовой системы, то формула для dU запишется в виде:
Здесь z — количество степеней свободы молекул, n — количество вещества, R — постоянная, dT — изменение температуры. Выражение выше следует из того факта, что внутренняя энергия идеального газа в точности равна кинетической энергии его молекул.
Из сравнения двух равенств получаем формулу для изохорной теплоемкости:
В случае воздуха z=5, поскольку он на 99 % состоит из двухатомных молекул азота и кислорода (двухатомные молекулы имеют 3 поступательные и 2 вращательные степени свободы). Полагая n=1 моль, приходим к формуле изохорной молярной теплоемкости воздуха:
Напомним, что постоянная R равна 8,314, тогда CV = 20,785 Дж/(моль*К).
Теперь определим молярную изобарную теплоемкость воздуха. Поскольку в результате изобарного нагрева газ расширяется, то он выполняет некоторую работу. Первое начало термодинамики в этом случае принимает вид:
Энтальпия H через изобарную теплоемкость CP для 1 моль вещества запишется так:
Работу газа с использованием уравнения Клапейрона-Менделеева можно записать так:
Эти выражения позволяют записать следующее соотношение изобарной и изохорной теплоемкостей:
Подставляя величину CV для воздуха, получаем изобарную молярную теплоемкость для него:
Таким образом, величина CP оказывается больше, чем CV.
Удельная и молярная теплоёмкость
Молярная теплоёмкость — теплоёмкость 1 моля вещества :
- CM=Cν=1νδQΔT,{\displaystyle C_{M}={\frac {C}{\nu }}={\frac {1}{\nu }}{\frac {\delta Q}{\Delta T}},}
где ν=mM,{\displaystyle \nu =m/M,} m{\displaystyle m} — масса, M{\displaystyle M} — молярная масса вещества.
Теплоёмкость единичной массы вещества называется удельной теплоёмкостью и, в системе СИ, измеряется в Дж/(кг·К).
Формула расчёта удельной теплоёмкости:
- где c — удельная теплоёмкость, m — масса нагреваемого (охлаждающегося) вещества.
Формулы изохорной и изобарной теплоемкостей воздуха

Сначала рассмотрим изохорную величину. Обозначим ее CV. Первое начало термодинамики, которое следует из закона сохранения энергии, для изохорного процесса выглядит следующим образом:
То есть все тепло H, подводимое к системе, идет на увеличение ее внутренней энергии. Изменение величины U можно записать так:
С другой стороны, если воспользоваться универсальным уравнением состояния идеальной газовой системы, то формула для dU запишется в виде:
Здесь z — количество степеней свободы молекул, n — количество вещества, R — постоянная, dT — изменение температуры. Выражение выше следует из того факта, что внутренняя энергия идеального газа в точности равна кинетической энергии его молекул.
Из сравнения двух равенств получаем формулу для изохорной теплоемкости:
В случае воздуха z=5, поскольку он на 99 % состоит из двухатомных молекул азота и кислорода (двухатомные молекулы имеют 3 поступательные и 2 вращательные степени свободы). Полагая n=1 моль, приходим к формуле изохорной молярной теплоемкости воздуха:
Напомним, что постоянная R равна 8,314, тогда CV = 20,785 Дж/(моль*К).
Теперь определим молярную изобарную теплоемкость воздуха. Поскольку в результате изобарного нагрева газ расширяется, то он выполняет некоторую работу. Первое начало термодинамики в этом случае принимает вид:
Энтальпия H через изобарную теплоемкость CP для 1 моль вещества запишется так:
Работу газа с использованием уравнения Клапейрона-Менделеева можно записать так:
Эти выражения позволяют записать следующее соотношение изобарной и изохорной теплоемкостей:
Подставляя величину CV для воздуха, получаем изобарную молярную теплоемкость для него:
Таким образом, величина CP оказывается больше, чем CV.
Теплоемкость и ее виды

Согласно физическому определению, теплоемкость — это величина, показывающая, сколько нужно на систему затратить теплоты, чтобы ее нагреть на 1 градус Цельсия или на 1 кельвин. Поскольку процессы нагревания и охлаждения являются обратимыми, то при охлаждении системы на 1 градус выделяется количество теплоты, равное ее теплоемкости.
Как физическая величина теплоемкость может быть абсолютной, молярной или массовой. Определение абсолютной теплоемкости для произвольной системы было дано выше. Молярной называется теплоемкость на 1 моль газа, массовой — на 1 кг газа. Молярная величина чаще используется для рассматриваемого агрегатного состояния материи.
В зависимости от изопроцесса, при котором измеряют теплоемкость, она бывает изохорной и изобарной. В первом случае в системе с газом не изменяется объем, во втором случае сохраняется давление.
Теплоёмкость идеального газа в изопроцессах
Адиабатический
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть dQ={\displaystyle dQ=0}. Однако, объём, давление и температура меняются, то есть dT≠{\displaystyle dT\neq 0}.
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю: C=dT={\displaystyle C={0 \over dT}=0}.
Изотермический
В изотермическом процессе постоянна температура, то есть dT={\displaystyle dT=0}. При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна плюс-минус бесконечности: C→±∞{\displaystyle C\to \pm \infty }
Изохорный
В изохорном процессе постоянен объём, то есть δV={\displaystyle \delta V=0} и, следовательно газ не совершает работы. Первое Начало Термодинамики для изохорного процесса имеет вид:
- dU=δQ=νCVdT.(1){\displaystyle dU=\delta Q=\nu C_{V}dT.\qquad (1)}
А для идеального газа
- dU=i2νRΔT.{\displaystyle dU={\frac {i}{2}}\nu R\Delta T.}
Таким образом,
- CV=i2R,{\displaystyle C_{V}={\frac {i}{2}}R,}
где i{\displaystyle i} — число частиц газа.
Другая формула:
- CV=Rγ−1,{\displaystyle C_{V}={\frac {R}{\gamma -1}},}
где γ{\displaystyle \gamma } — показатель адиабаты, R{\displaystyle R} — газовая постоянная газа.
Изобарный
Молярная теплоёмкость при постоянном давлении обозначается как Cp{\displaystyle C_{p}}. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера Cp=Cv+R{\displaystyle C_{p}=C_{v}+R}.
Уравнение Майера вытекает из первого начала термодинамики:
- δQ=dU+δA,(2){\displaystyle \delta Q=\mathrm {d} U+\delta A,\qquad (2)}.
В рассматриваемом случае, согласно определению теплоёмкости:
- δQ=CpdT,{\displaystyle \delta Q=C_{p}\mathrm {d} T,}
Учитываем, что работа газа равна :
- δA=d(pV)=nRdT=pdV+Vdp=pdV,(Vdp=)(3){\displaystyle \delta A=\mathrm {d} (pV)=nR\mathrm {d} T\qquad =p\mathrm {d} V\qquad +V\mathrm {d} p\qquad =p\mathrm {d} V\qquad ,(V\mathrm {d} p\qquad =0)(3)}
Согласно уравнению Менделеева-Клапейрона для одного моля газа:
- pdV=RdT.(4){\displaystyle p\mathrm {d} V=R\mathrm {d} T.\qquad (4)}
Подставляя уравнение (4) в (3) получаем:
- δA=RdT(5){\displaystyle \delta A=R\mathrm {d} T\qquad (5)}
Так как энергия одной молекулы равна <e>=i2kT{\displaystyle <e>={\frac {i}{2}}kT} (6), то и внутренняя энергия в целом и при изобарном процессе будет определяться по соотношению (1). Следовательно, подставляя уравнения (1) и (5) в (2) получаем соотношение Майера.
Молекулярно-кинетическая теория позволяет вычислить значения молярной теплоёмкости для классического идеального газа газов через значение универсальной газовой постоянной исходя из уравнения (6) и предположения, что молекулы газа не взаимодействуют между собой:
- для общего случая Cp=i+22R,{\displaystyle C_{p}={\frac {i+2}{2}}R,}
- для одноатомных газов Cp=52R,{\displaystyle C_{p}={\frac {5}{2}}R,} то есть около 20.8 Дж/(моль·К);
- для двухатомных газов и многоатомных газов с линейными молекуламиCp=72R,{\displaystyle C_{p}={\frac {7}{2}}R,} то есть около 29.1 Дж/(моль·К);
- для многоатомных газов с нелинейными молекуламиCp=4R,{\displaystyle C_{p}=4R,} то есть около 33.3 Дж/(моль·К).
Теплоёмкости можно также определить исходя из уравнения Майера, если известен показатель адиабаты, который можно измерить экспериментально (например, с помощью измерения скорости звука в газе или используя метод Клемана — Дезорма).
Теплоёмкость реального газа может значительно отклонятся от теплоёмкости идеального газа. Так при температуре в 25 °С и атмосферном давлении атомарный водород имеет теплоёмкость 2,50R , а атомарный кислород — 2,63R. Также теплоёмкость реального газа зависит от температуры.
Внутренняя энергия газа
Внутренняя энергия любой системы — это физическая характеристика, которая равна сумме потенциальной и кинетической энергии. Поскольку в идеальных газах можно пренебречь потенциальной энергией, то для них можно записать равенство:
Где Ek — энергия кинетическая системы. Используя молекулярно-кинетическую теорию и применяя универсальное уравнение состояния Клапейрона-Менделеева, несложно получить выражение для U. Оно записано ниже:
Здесь T, R и n — абсолютная температура, газовая постоянная и количество вещества соответственно. Величина z — это целое число, показывающее количество степеней свободы, которыми обладает молекула газа.