Абсолютная температура
Содержание:
- Взаимодействие атомов между собой
- Температура абсолютная идеального газа
- Физические основы построения термодинамической шкалы температур
- Абсолютная температурная шкала. Абсолютный нуль
- Основные единицы
- Газовое состояние вещества
- Измерения по Цельсию
- «Тепловое равновесие. Температура. Шкала Цельсия»
- Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся
- Что такое парциальное давление
Взаимодействие атомов между собой
При
рассмотрении реальных
газов —
газов,
свойства которых зависят от взаимодействия
молекул, надо учитывать силы
межмолекулярного взаимодействия. Они
проявляются
на расстояниях 10-9
м и быстро убывают при увеличении
расстояния между молекулами. Такие
силы называются короткодействующими.
В XX
в., по мере развития представлений о
строении атома и квантовой механики,
было выяснено, что между молекулами
вещества одновременно действуют силы
притяжения и силы отталкивания. На
рис. 88, априведена
качественная зависимость сил
межмолекулярного взаимодействия от
расстояния r
между молекулами, где Fo
и Fп—
соответственно силы отталкивания и
притяжения, aF—
их результирующая. Силы отталкивания
считаются положительными,а
силы взаимного притяжения —отрицательными.
На
расстоянии r
= rрезультирующая
сила F=0,
т. е. силы притяжения и отталкивания
уравновешивают друг друга. Таким
образом, расстояние rсоответствует
равновесному расстоянию между молекулами,
на котором бы они находились в отсутствие
теплового движения. При r
преобладают
силы отталкивания (F>0),
при r>r
— силы притяжения (F10-9
м межмолекулярные силы взаимодействия
практически отсутствуют (F0).
Элементарная
работа A
силы Fпри
увеличении расстояния между молекулами
на drсовершается
за счет уменьшения взаимной
потенциальной энергии молекул, т. е.
A=Fdr=-dП.
(60.1)
Из
анализа качественной зависимости
потенциальной энергии взаимодействия
молекул от расстояния между ними
(рис. 88, б)следует,
что если молекулы находятся друг от
друга на расстоянии, на котором
межмолекулярные силы взаимодействия
не действуют (г),
то П=0. При постепенном сближении молекул
между ними появляются силы притяжения
(F0).
Тогда, согласно (60.1), потенциальная
энергия взаимодействия уменьшается,
достигая минимума при r=r.
При rrс
уменьшением rсилы
отталкивания (F>0)резко
возрастают и совершаемая против них
работа отрицательна (A=FdrПотенциальная
энергия начинает тоже резко возрастать
и становится положительной. Из данной
потенциальной кривой следует, что
система из двух взаимодействующих
молекул в состоянии устойчивого
равновесия (r=r)
обладает минимальной потенциальной
энергией.
Критерием
различных агрегатных состояний
вещества является соотношение величин
Пmin
и kT.Пmin
— наименьшая потенциальная энергия
взаимодействия молекул — определяет
работу, которую нужно совершить против
сил притяжения для того, чтобы
разъединить молекулы, находящиеся
в равновесии (r=r);kTопределяет
удвоенную среднюю энергию, приходящуюся
на одну степень свободы хаотического
теплового движения молекул.
Если
Пmin0,т.
е. вероятность образования агрегатов
из молекул достаточно мала. Если
IImin>>kT,
то вещество находится в твердом состоянии,
так как молекулы, притягиваясь друг к
другу, не могут удалиться на значительные
расстояния и колеблются около
положений равновесия, определяемого
r0.
Если ПminkT,то
вещество находится в жидком состоянии,
так как в результате теплового движения
молекулы перемещаются в пространстве,
обмениваясь местами, но не расходясь
на расстояние, превышающее r.Таким
образом, любое вещество в зависимости
от температуры может находиться в
газообразном, жидком или твердом
агрегатном состоянии, причем температура
перехода из одного агрегатного состояния
в другое зависит от значения Пmin
для данного вещества. Например, у инертных
газов Пmin
мало, а у металлов — велико, поэтому
при обычных (комнатных) температурах
они находятся соответственно в
газообразном и твердом состояниях.
Температура абсолютная идеального газа
Существует два подхода к определению температуры в газах. Рассмотрим каждый из них.
Первый подход заключается в привлечении положений молекулярно-кинетической теории (МКТ) и физического смысла самой температуры T. Последний заключается в кинетической энергии частиц газа. Чем больше эта энергия, тем выше температура, причем зависимость является прямо пропорциональной. Используя формулу из механики для энергии кинетической и постоянную Больцмана kB можно записать следующее равенство МКТ:
Где m — масса движущейся поступательно частицы. Выражая из этого равенства величину T, получаем формулу:
Чем меньше масса частицы и чем больше ее скорость, тем выше абсолютная температура.
Второй подход в определении величины T заключается в использовании универсального уравнения Клапейрона-Менделеева. Это уравнение было записано в XIX веке Эмилем Клапейроном (впоследствии модифицировано Д. И. Менделеевым) как результат обобщения открытых экспериментально в XVII-XIX веках газовых законов (Шарля, Гей-Люссака, Бойля-Мариотта, Авогадро). Математически универсальное уравнение записывается так:
Не представляет особого труда получить формулу для температуры из Клапейрона-Менделеева закона:
В закрытой системе (n = const) температура газа прямо пропорциональна произведению объема на давление.
Физические основы построения термодинамической шкалы температур
1. Термодинамическая шкала температур принципиально может быть построена на основании теоремы Карно, которая утверждает, что коэффициент полезного действия идеального теплового двигателя не зависит от природы рабочего тела и конструкции двигателя, и зависит только от температур нагревателя и холодильника.
- η=Q1−Q2Q1=T1−T2T1,{\displaystyle \eta ={\frac {Q_{1}-Q_{2}}{Q_{1}}}={\frac {T_{1}-T_{2}}{T_{1}}},}
где Q1{\displaystyle Q_{1}} — количество теплоты, полученной рабочим телом (идеальным газом) от нагревателя, Q2{\displaystyle Q_{2}} — количество теплоты, отданное рабочим телом холодильнику, T1,T2{\displaystyle T_{1},T_{2}} — температуры нагревателя и холодильника, соответственно.
Из приведённого выше уравнения следует соотношение:
- Q1Q2=T1T2.{\displaystyle {\frac {Q_{1}}{Q_{2}}}={\frac {T_{1}}{T_{2}}}.}
Это соотношение может быть использовано для построения абсолютной термодинамической температуры. Если один из изотермических процессов цикла Карно Q3{\displaystyle Q_{3}} проводить при температуре тройной точки воды (реперная точка), установленной произвольно ─ T3=273,16K,{\displaystyle T_{3}=273{,}16\,K,} то любая другая температура будет определяться по формуле T=273,16QQ3{\displaystyle T=273{,}16{\frac {Q}{Q_{3}}}}. Установленная таким образом температурная шкала называется термодинамической шкалой Кельвина. К сожалению, точность измерения количества теплоты невысока, что не позволяет реализовать вышеописанный способ на практике.
2. Абсолютная температурная шкала может быть построена, если использовать в качестве термометрического тела идеальный газ. В самом деле, из уравнения Клапейрона вытекает соотношение
- T=pVR.{\displaystyle T={\frac {pV}{R}}.}
Если измерять давление газа, близкого по свойствам к идеальному, находящегося в герметичном сосуде постоянного объёма, то таким способом можно установить температурную шкалу, которая носит название идеально-газовой. Преимущество этой шкалы состоит в том, что давление идеального газа при V=const{\displaystyle V=const} изменяется линейно с температурой. Поскольку даже сильно разреженные газы по своим свойствам несколько отличаются от идеального газа, то реализация идеально-газовой шкалы связана с определёнными трудностями.
3. В различных учебниках по термодинамике приводятся доказательства того, что температура, измеренная по идеально-газовой шкале, совпадает с термодинамической температурой. Следует, однако, оговориться: несмотря на то, что численно термодинамическая и идеально-газовая шкалы абсолютно идентичны, с качественной точки зрения между ними есть принципиальная разница. Только термодинамическая шкала является абсолютно независимой от свойств термометрического вещества.
4. Как уже было указано, точное воспроизведение термодинамической шкалы, а также идеально-газовой, сопряжено с серьёзными трудностями. В первом случае необходимо тщательно измерять количество теплоты, которая подводится и отводится в изотермических процессах идеального теплового двигателя. Такого рода измерения неточны. Воспроизведение термодинамической (идеально-газовой) температурной шкалы в диапазоне от 10 до 1337 K возможно с помощью газового термометра. При более высоких температурах заметно проявляется диффузия реального газа сквозь стенки резервуара, а при температурах в несколько тысяч градусов многоатомные газы распадаются на атомы. При ещё больших температурах реальные газы ионизируются и превращаются в плазму, которая не подчиняется уравнению Клапейрона. Наиболее низкая температура, которая может быть измерена газовым термометром, заполненным гелием при низком давлении равна 1 K. Для измерения температур за пределами возможностей газовых термометров используют специальные методы измерения. Подробнее см. Термометрия.
С этим читают
Абсолютная температурная шкала. Абсолютный нуль
Выбор в качестве основных точек температурной шкалы точек таяния льда и кипения воды совершенно произволен. Полученная таким образом температурная шкала оказалась неудобной для теоретических исследований.
Опираясь на законы термодинамики, Кельвину удалось построить так называемую абсолютную температурную шкалу (ее в настоящее время называют термодинамической шкалой температур или шкалой Кельвина), совершенно не зависящую ни от природы термометрического тела, ни от избранного термометрического параметра. Однако принцип построения такой шкалы выходит за пределы школьной программы.
Мы рассмотрим этот вопрос, используя другие соображения.
Из формулы (2) вытекают два возможных способа установления температурной шкалы: использование изменения давления определенного количества газа при постоянном объеме или изменение объема при постоянном давлении. Такую шкалу называют идеальной газовой шкалой температуры.
Температура, определяемая равенством (2), называется абсолютной температурой. Абсолютная температура Τ не может быть отрицательной, так как слева в равенстве (2) стоят заведомо положительные величины (точнее, она не может быть разных знаков, она может быть либо положительной, либо отрицательной. Это зависит от выбора знака постоянной k. Так как условились температуру тройной точки считать положительной, то абсолютная температура может быть только положительной). Следовательно, наименьшее возможное значение температуры Т = 0 есть температура, когда давление или объем равны нулю.
Предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю (т.е. газ как бы должен сжаться в «точку») при неизменном давлении, называется абсолютным нулем. Это самая низкая температура в природе.
Из равенства (3), учитывая, что \(~\mathcal h W_K \mathcal i = \frac{m_0 \mathcal h \upsilon^2 \mathcal i}{2}\) , вытекает физический смысл абсолютного нуля: абсолютный нуль — температура, при которой должно прекратиться тепловое поступательное движение молекул. Абсолютный нуль недостижим.
В Международной системе единиц (СИ) используют абсолютную термодинамическую шкалу температур. За нулевую температуру по этой шкале принят абсолютный нуль. В качестве второй опорной точки принята температура, при которой находятся в динамическом равновесии вода, лед и насыщенный пар, так называемая тройная точка (по шкале Цельсия температура тройной точки равна 0,01 °С). Каждая единица абсолютной температуры, называемая Кельвином (обозначается 1 К), равна градусу Цельсия.
Погружая колбу газового термометра в тающий лед, а затем в кипящую воду при нормальном атмосферном давлении, обнаружили, что давление газа во втором случае в 1,3661 раза больше, чем в первом. Учитывая это и пользуясь формулой (2), можно определить, что температура таяния льда T = 273,15 К.
Действительно, запишем уравнение (2) для температуры T таяния льда и температуры кипения воды (T + 100):
Разделим второе уравнение на первое, получим:
Отсюда
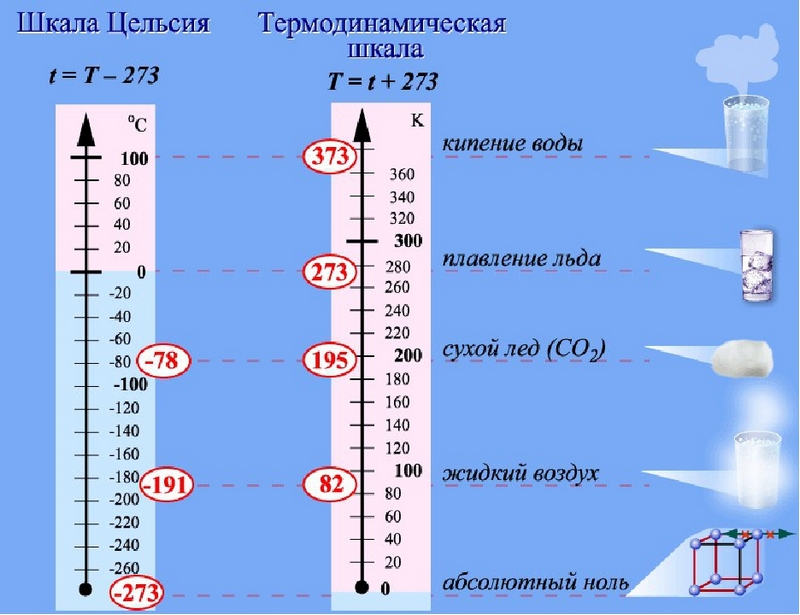
На рисунке 2 схематически показаны шкала Цельсия и термодинамическая шкала.

Так как 1 К = 1 °С, то любое значение температуры Τ будет на 273,15 градуса выше соответствующей температуры t по Цельсию: Т = t + 273,15. Но изменение абсолютной температуры ΔΤ равно изменению температуры Δt по шкале Цельсия: Δt = ΔΤ.
Основные единицы
В таблице представлены все основные единицы СИ вместе с их определениями, российскими и международными обозначениями, физическими величинами, к которым они относятся, а также с кратким обоснованием их происхождения.
| Единица | Обозначение | Величина | Определение | Историческое происхождение, обоснование |
|---|---|---|---|---|
| Секунда | сs | Время | Величина секунды устанавливается фиксацией численного значения частоты сверхтонкого расщепления основного состояния атома цезия-133 при температуре 0 К равным в точности 9 192 631 770, когда она выражена единицей СИ с−1, что эквивалентно Гц. | Солнечные сутки разбиваются на 24 часа, каждый час разбивается на 60 минут, каждая минута разбивается на 60 секунд.Секунда — это 1⁄(24 × 60 × 60) часть солнечных суток.Современное определение принято на XIII Генеральной конференции по мерам и весам (ГКМВ) в 1967 году. |
| Метр | мm | Длина | Величина метра устанавливается фиксацией численного значения скорости света в вакууме равным в точности 299 792 458, когда она выражена единицей СИ м·с−1. | 1⁄10 000 000 расстояния от экватора Земли до северного полюса на меридиане Парижа.Современное определение установлено XVII ГКМВ в 1983 г. |
| Килограмм | кгkg | Масса | Величина килограмма устанавливается фиксацией численного значения постоянной Планка h равным в точности 6,626 070 15 × 10−34, когда она выражена в Дж⋅с. | Масса одного кубического дециметра (литра) чистой воды при температуре 4 °C и стандартном атмосферном давлении на уровне моря. В течение более чем двухсот лет эталоном килограмма служили материальные образцы — Архивный килограмм, затем Международный прототип килограмма. |
| Ампер | АA | Сила электрического тока | Величина ампера устанавливается фиксацией численного значения элементарного заряда e равным 1,602 176 634 × 10−19, когда он выражен в кулонах. | Предыдущее определение, восходящее к изначальному: ампер есть сила не изменяющегося тока, который при прохождении по двум параллельным прямолинейным проводникам бесконечной длины и ничтожно малой площади кругового поперечного сечения, расположенным в вакууме на расстоянии 1 м один от другого, вызвал бы на каждом участке проводника длиной 1 м силу взаимодействия, равную 2⋅10−7ньютонов. |
| Кельвин | КK | Термодинамическая температура | Величина кельвина устанавливается фиксацией численного значения постоянной Больцмана k равным в точности 1,380 649 × 10−23, когда она выражена в Дж/К. | В 1967—2019 годах определялся как 1/273,16 части тройной точки воды. Шкала Кельвина использует тот же шаг, что и шкала Цельсия, но 0 кельвинов — это температура абсолютного нуля, а не температура плавления льда. Согласно современному определению ноль шкалы Цельсия установлен таким образом, что температура тройной точки воды равна 0,01 °C. В итоге шкалы Цельсия и Кельвина сдвинуты на 273,15: T = T − 273,15. |
| Моль | мольmol | Количество вещества | Один моль содержит ровно 6,022 140 76 × 1023 элементов. Это число — фиксированное значение постоянной Авогадро NA, выраженной в единицах моль−1, и называется числом Авогадро. | Атомный вес или молекулярный вес, деленный на постоянную молярной массы, 1 г/моль. В 1971—2019 годах определялся как количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 12 г. |
| Кандела | кдcd | Сила света | Величина канделы устанавливается фиксацией численного значения световой эффективности монохроматического излучения частотой 540·1012 Гц равным в точности 683, когда она выражена единицей СИ м−2·кг−1·с3·кд·ср или кд·ср·Вт−1, что эквивалентно лм·Вт−1. | Сила света (англ. Candlepower, устар. Британская единица силы света), испускаемая горящей свечой.Современное определение установлено XVI ГКМВ в 1979 г. |
Наименования и обозначения основных единиц, так же как и всех других единиц СИ, пишутся маленькими буквами (например, метр и его обозначение м). У этого правила есть исключение: обозначения единиц, названных фамилиями учёных, пишутся с заглавной буквы (например, ампер обозначается символом А).
Газовое состояние вещества
Каждый школьник хорошо представляет, о каком состоянии материи идет речь, когда слышит слово «газ». Под этим словом понимают тело, которое способно занимать любой предоставленный ему объем. Оно не способно сохранять форму, поскольку не может сопротивляться даже самому незначительному внешнему воздействию. Также газ не сохраняет и объем, что его отличает не только от твердых тел, но и от жидкостей.
Как и жидкость, газ является текучей субстанцией. В процессе движения твердых тел в газах последние препятствуют этому движению. Появившуюся силу называют сопротивлением. Ее величина зависит от скорости движения тела в газе.
Яркими примерами газов является воздух, природный газ, который используется для отопления домов и приготовления пищи, инертные газы (Ne, Ar), которыми заполняют рекламные трубки тлеющего разряда, или которые используют для создания инертной (неагрессивной, защитной) среды при сварке.
Измерения по Цельсию
Система измерения температурного градуса по Цельсию взяла своё название по имени Андерса Цельсия, шведского физика, разработавшего в 1742 году шкалу измерения температур. Учёный предположил, что такие физические процессы, как закипание воды, или таяние льда, напрямую зависят от давления в окружающей атмосфере. Это затрудняло исследования по определению точных показаний.
Шкала по Цельсию имела диапазон от 0 до 100 градусов со знаком «+», который продолжается вниз или вверх до бесконечности. Это являлось проблемой для точного измерения величин, поскольку известно, что ниже +4 °C вода имеет свойство расширяться и при дальнейшем понижении температуры даёт неправильные показания градусных значений.
Пересмотрена и модернизирована шкала температур по Цельсию была лишь после одобрения научным миром разработок физика Уильяма Томсона (Кельвина). Именно тогда была представлена постоянная температурная величина и принято определение, что 1 градус Цельсия равен 274,15 Кельвинам.

«Тепловое равновесие. Температура. Шкала Цельсия»
Молекулярная физика в отличие от механики изучает системы (тела), состоящие из большого числа частиц. Эти тела могут находиться в различных состояниях, которые называются параметрами состояния. К параметрам состояния относят давление, объём, температуру. Возможно такое состояние системы, при котором параметры, характеризующие его, остаются неизменными сколь угодно долго при отсутствии внешних воздействий. Это состояние называется тепловое равновесие. Так, объём, температура, давление жидкости в сосуде, находящейся в тепловом равновесии с воздухом в комнате, не изменяются, если для этого не будет каких-либо внешних причин.
Температура
Состояние теплового равновесия системы характеризует такой параметр, как температура. Особенностью его является то, что значение температуры во всех частях системы, находящейся в состоянии теплового равновесия, одинаково. Если опустить в стакан с горячей водой серебряную ложку (или ложку из любого другого металла), то ложка будет нагреваться, а вода — остывать. Это будет происходить до тех пор, пока не наступит тепловое равновесие, при котором ложка и вода будут иметь одинаковую температуру, т.е. придут в тепловое равновесие.
Температура — это физическая величина, которая характеризует тепловое состояние тела. Так, температура горячей воды выше, чем холодной; зимой температура воздуха на улице ниже, чем летом.
Единицей температуры является градус Цельсия (°С). Температуру измеряют термометром.
В основе устройства термометра и соответственно способа измерения температуры лежит зависимость свойств тел от температуры, в частности свойство тела расширяться при нагревании. В термометрах могут быть использованы разные тела: и жидкие (спирт, ртуть), и твёрдые (металлы) и газообразные. Их называют термометрическими телами. Термометрическое тело (жидкость или газ) помещают в трубку, снабжённую шкалой, её приводят в соприкосновение с телом, температуру которого хотят измерить.
Повышение температуры газа означает увеличение средней скорости хаотического движения его молекул. Аналогично с повышением температуры возрастает скорость перемещения молекул жидкости и возрастает амплитуда колебаний атомов твердых тел.
Шкала Цельсия. Шкала Кельвина
Существуют разные температурные шкалы. Одной из наиболее распространённых в практике шкал является шкала Цельсия. Основными точками этой шкалы служат температура таяния льда и температура кипения воды при нормальном атмосферном давлении (760 мм рт. ст.). Первой точке приписали значение 0 °С, а второй — 100 °С. Расстояние между этими точками разделили на 100 равных частей и получили шкалу, называемую шкала Цельсия. За единицу температуры по этой шкале принят 1 °С.
Помимо шкалы Цельсия широко используется температурная шкала, названная абсолютной (термодинамической) шкалой температур, или шкала Кельвина. Температура любого тела не может опуститься ниже -273,15 °С. При такой температуре движение молекул полностью прекращается. За ноль по шкале Кельвина принята температура -273,15 °С. Эта температура названа абсолютным нулём температур и обозначается 0 К. Единицей температуры является один кельвин (1 К); он равен 1 градусу Цельсия. Соответственно температура таяния льда по абсолютной шкале температур — 273 К, а температура кипения воды — 373 К.
Температуру по абсолютной шкале обозначают буквой Т. Связь между температурой по абсолютной шкале (Т) и температурой по шкале Цельсия (t°) выражается формулой:
Т = t° + 273.
Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся
Основные формулы термодинамики и молекулярной физики, которые Вам пригодятся.
Вот он, еще один отличный день для практических занятий по физике. Сегодня, дорогие друзья, мы соберем вместе формулы, которые чаще всего используются при решении задач в термодинамике и молекулярной физике.
Итак, поехали. Попытаемся изложить законы и формулы термодинамики кратко.
Идеальный газ
Идеальный газ – это идеализация, как и материальная точка. Молекулы такого газа являются материальными точками, а соударения молекул – абсолютно упругие. Взаимодействием же молекул на расстоянии пренебрегаем. В задачах по термодинамике реальные газы часто принимаются за идеальные. Так гораздо легче жить, и не нужно иметь дела с массой новых членов в уравнениях.
Итак, что происходит с молекулами идеального газа? Да, они движутся! И резонно спросить, с какой скоростью? Конечно, помимо скорости молекул нас интересует еще и общее состояние нашего газа. Какое давление P он оказывает на стенки сосуда, какой объем V занимает, какая у него температура T.
Для того, чтобы узнать все это, есть уравнение состояния идеального газа, или уравнение Клапейрона-Менделеева
Здесь m – масса газа, M – его молекулярная масса (находим по таблице Менделеева), R – универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль*кг).
Универсальная газовая потоянная может быть выражена через другие константы (постоянная Больцмана и число Авогадро)
Массу, в свою очередь, можно вычислить, как произведение плотности и объема.
Основное уравнение молекулярно-кинетической теории (МКТ)
Как мы уже говорили, молекулы газа движутся, причем, чем выше температура – тем быстрее. Существует связь между давлением газа и средней кинетической энергией E его частиц. Эта связь называется основным уравнением молекулярно-кинетической теории и имеет вид:
Здесь n – концентрация молекул (отношение их количества к объему), E – средняя кинетическая энергия. Найти их, а также среднюю квадратичную скорость молекул можно, соответственно, по формулам:
Подставим энергию в первое уравнение, и получим еще один вид основного уравнения МКТ
Первое начало термодинамики. Формулы для изопроцессов
Напомним Вам, что первый закон термодинамики гласит: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа U и на совершение газом работы A. Формула первого закона термодинамики записывается так:
Как известно, с газом что-то происходит, мы можем сжать его, можем нагреть. В данном случае нас интересуют такие процессы, которые протекают при одном постоянном параметре. Рассмотрим, как выглядит первое начало термодинамики в каждом из них
Изотермический – протекает при постоянной температуре. Тут работает закон Бойля-Мариотта: в изотермическом процессе давление газа обратно пропорционально его объёму. В изотермическом процессе:
Изохорный – протекает при поcтоянном объеме. Для этого процесса характерен закон Шарля: При постоянном объеме давление прямо пропорционально температуре. В изохорном процессе все тепло, подведенное к газу, идет на изменение его внутренней энергии.
Изобарный – идет при постоянном давлении. Закон Гей-Люссака гласит, что при постоянном давлении газа его объём прямо пропорционален температуре. При изобарном процессе тепло идет как на изменение внутренней энергии, так и на совершение газом работы.
Адиабатный процесс. Адиабатный процесс – это такой процесс, который проходит без теплообмена с окружающей средой. Это значит, что формула первого закона термодинамики для адиабатного процесса выглядит так:
Теплоемкость
Удельная теплоемкость равна количеству теплоты, которое необходимо для нагревания одного килограмма вещества на один градус Цельсия.
Помимо удельной теплоемкости, есть молярная теплоемкость (количество теплоты, необходимое для нагревания одного моля вещества на один градус) при постоянном объеме, и молярная теплоемкость при постоянном давлении. В формулах ниже, i – число степеней свободы молекул газа. Для одноатомного газа i=3, для двухатомного – 5.
Тепловые машины. Формула КПД в термодинамике
Тепловая машина, в простейшем случае, состоит из нагревателя, холодильника и рабочего тела. Нагреватель сообщает тепло рабочему телу, оно совершает работу, затем охлаждается холодильником, и все повторяется вновь. Типичным примером тепловой машины является двигатель внутреннего сгорания.
Коэффициент полезного действия тепловой машины вычисляется по формуле
Иван Колобков, известный также как Джони. Маркетолог, аналитик и копирайтер компании Zaochnik. Подающий надежды молодой писатель. Питает любовь к физике, раритетным вещам и творчеству Ч. Буковски.
Что такое парциальное давление
Воздух – это смесь газов. Больше всего в нем содержится азота – 78 процентов. Так же, содержится кислород в виде молекул \(O_{2}\) и \(O_{3}\) — озона, он составляет 21 процент. Остальные , среди них инертные газы и углекислый газ, составляют 1 процент. Давление воздуха складывается из давлений каждого входящего в воздух газа.
Поясним это на простом примере. Рассмотрим емкость, например – обычную трехлитровую стеклянную банку для консервации. Когда в банке нет съестных припасов, ее объем целиком занимает воздух. Давление воздуха в банке будет равно атмосферному давлению. Закупорим банку крышкой. Предположим, у нас имеется возможность отдельно отфильтровать из воздуха каждый газ.
Будем проводить такой опыт:
- Вначале измерим давление воздуха в банке.
- Затем, откачаем из банки все газы, кроме одного. Этот отдельно взятый газ при той же температуре занимает весь объём, который до этого занимала газовая смесь. С помощью манометра измерим давление, которое создает оставшийся газ. Давление оставшегося газа называется парциальным давлением.
- Далее, вернем в банку газы, откачанные ранее.
- После этого отфильтруем какой-либо другой газ, оставляя в банке его и, откачивая все остальные газы. Будем измерять манометром парциальное давление оставшегося газа.
Проделав такой опыт несколько раз, мы получим парциальные давления всех газов, из которых состоит воздух.
Примечания:
- Парциальное от итальянского «парцио» — часть. Имеется ввиду часть чего-то целого.
- Манометр – прибор для измерения давления (ссылка).
- Тела в занимают весь предложенный им объем. По мере удаления газов, масса вещества в банке будет уменьшаться. Но оставшийся газ будет занимать весь объем банки, создавая давление на ее стенки.
Связь общего давления и парциальных давлений всех газов смеси с помощью математики можно описать так:
\
\(\large P_{\text{общ}} \left(\text{Па} \right) \) – давление смеси газов (общее давление);
\(\large P_{1} \left(\text{Па} \right) \) – парциальное давление первого газа;
\(\large P_{2} \left(\text{Па} \right) \) – парциальное давление второго газа;
Каждый газ создает свой вклад в общее давление смеси. Этот вклад называют парциальным давлением газа.
Если сложить парциальные давления всех газов, получим давление воздуха, которое мы измерили в начале эксперимента, перед тем, как начать откачивать газы из банки.